Průběh HPV infekce
Karcinom děložního hrdla je vzácnou a pozdní komplikací banální virové infekce. Přesto je zdrojem útrap a vážným zdravotním i sociálním problémem. Každým rokem onemocní na světě 400 000 žen, v Evropě asi 50 000, ponejvíce mladých (mezi 30 a 50 lety), a polovina z nich na tuto diagnózu umírá. V naší zemi onemocní ročně více než 1000, umírá 400 žen. V několika posledních letech byla tato problematika opětovně pojednávána i českou lékařskou odbornou veřejností. S realizací vakcinace v naší zemi je opět potřebný souhrn základních informací.
Virus HPV
 Viry papilomatózních lézí se vyskytují u všech obratlovců, každý je však druhově specifický. Virus HPV patrně provází člověka po miliony let vývoje lidského druhu. Existuje v podobě infekčních částic – virionů – o průměru 55 nm, jejichž povrch (eikosaedrální kapsida) má tvar symetrického dvacetistěnu ze 72 pětiúhelníkových plošek (kapsomer). Strukturální jednotkou je nukleokapsida. Obsahuje kruhový genom dvouřetězcové DNA (biologický substrát paměti se 7900 páry bází), bez lipidové obálky, jen splášťovými proteiny (L1, L2 ahistony) [35, 36, 45].
Viry papilomatózních lézí se vyskytují u všech obratlovců, každý je však druhově specifický. Virus HPV patrně provází člověka po miliony let vývoje lidského druhu. Existuje v podobě infekčních částic – virionů – o průměru 55 nm, jejichž povrch (eikosaedrální kapsida) má tvar symetrického dvacetistěnu ze 72 pětiúhelníkových plošek (kapsomer). Strukturální jednotkou je nukleokapsida. Obsahuje kruhový genom dvouřetězcové DNA (biologický substrát paměti se 7900 páry bází), bez lipidové obálky, jen splášťovými proteiny (L1, L2 ahistony) [35, 36, 45].
Virus je relativně stabilní a odolný. Ve vlhkém prostředí je infekční několik měsíců. Molekulární organizace všech nyní již více než 130 odlišných typů dosud izolovaných je homologní ve sledu párů bází DNA z více než 90%. V jednom z obou řetězců je v genomu všech virů HPV vždy 8–10 otevřených okének ve třech úsecích (dlouhý regulační, který nekóduje, úsek raných proteinů E1–E8 aúsek pozdních plášťových proteinů L1 a L2). Biologická paměť se realizuje tvorbou proteinů.
Funkce jednotlivých proteinů
- E1 – protein počátku virové replikace
- E2 – protein regulátoru transkripce viru
- E3 – patrně bezvýznamný
- E4 – protein uvolnění infekčních virionů do okolí
- E5 – onkogen růstového faktoru, ochrana proti cytotoxickým T lymfocytům
- E6 – inaktivuje ochránce buněčné integrity, buněčný protein p53 aaktivuje telomerázu
- E7 – inaktivuje tumor-supresorový buněčný protein pRb, imortalizuje buňku
- E8 – snad faktor latentní virové infekce vbazálních buňkách epitelu
- L1 – hlavní strukturální protein výstavby virového obalu (kapsidy)
- L2 – protein zabalení virové DNA do virionu [73, 78, 84]
Třídění virů HPV
Současné typologické třídění virů HPV vychází ze sekvenční analýzy, klinicko-patologických důsledků infekce, z funkčních igenetických vlastností: virus je soběstačný, nezávislý patogen. Infekci virem lze detegovat morfologicky, hybridizací in situ, polymerázovou řetězovou reakcí, imunohistochemicky (protilátkami proti antigenu kódovanému genem L1).
Virus lidských papilomatózních lézí se replikuje výlučně na kůži nebo sliznicích v genitáliích, v análním prstenci, v dutině ústní a v dýchacích cestách.Jednotlivé typy HPV infikují vždy určitou anatomickou lokalitu, kde jádra tamních epiteliálních buněk určitý virový genom aktivně přepisují. Imunitní odezva je buněčné povahy, nejspíše specifická k jednotlivým typům virů. K viremii srozsevem na vzdálená místa nedochází.
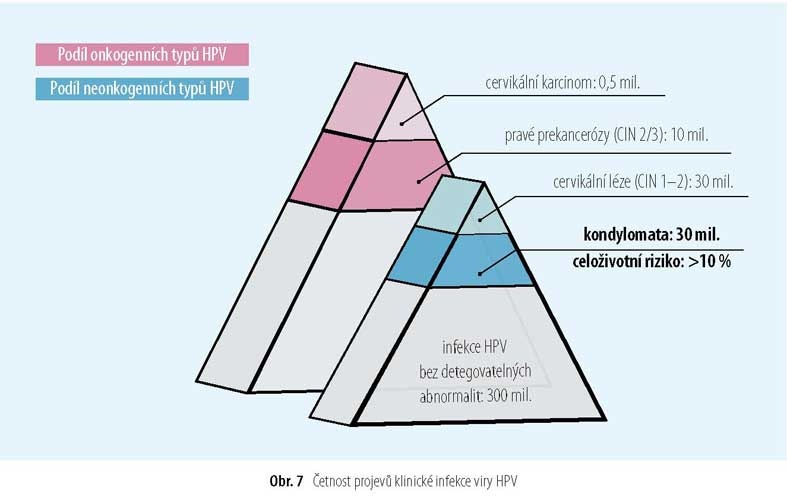
Projevy infekce HPV
Při produktivních infekcích dochází k lokální hyperproliferaci keratinocytů, někdy se zřejmými projevy v podobě exofytických výrůstků, často však probíhají bezpříznakově [39, 45, 60]. Virus HPV je nezbytnou příčinou onkogeneze epiteliálních tumorů anogenitální oblasti (prokázán u karcinomů cervixu v 99,7%, identický v metastázách a v primární lézi, způsobuje in vitro často buněčné transformace, virový genom je aktivně přepisován). Anatomickým substrátem, vstupní branou a pak kultivační půdou pro inokulaci viru jsou mikrotraumata kůže nebo sliznice [15, 34]. Virus může osídlit každou evoluční niku, ve které je imunitní odezva chabá (obr. 8).
Infekce kůže
Benigní produktivní změny na kůži asi 10% infikovaných osob jsou veruky (bradavice), na sliznicích papilomy. Přenášejí se přímým kontaktem nebo kontaminovanými poréznímipředměty. Anatomická léze na kůži či sliznici je patrná někdy již po několika týdnech, někdy až za rok i delší dobu [45].
Verruca vulgaris
Verruca vulgaris (angl. common warts) se projevuje hyperkeratotickými papulonoduly na rukou, pažích a končetinách, kdekoli na neochlupené kůži, léze přisedlé až stopkaté, běžné v dětství (nevyzrálá buněčná imunitní odezva), u řezníků, prodavačů drůbeže a ryb. Zvláštní profesionální vnímavost („butcher's warts" – HPV2 aHPV7) nebyla ještě zcela vysvětlena. 10× větší je i prevalence u dětí i dospělých satopií a u dospělých simunosupresí. Viry, které způsobují vznik veruk (HPV 1, 2, 4, 7, 27, 57, 60, 65), mají afinitu ke keratinizované epidermis a nejsou příčinou vzniku genitálních kondylomů. Výjimkou jsou orální i genitální léze z autoinokulace (HPV 2 ij iné). U malých dětí je obvyklé spontánní zhojení, v polovině případů do dvou let. Problémem mohou být veruky periunguální, vyžadující individuální volbu léčby. Pozoruhodné tloušťky mohou dosahovat veruky planto-palmární (HPV 1, HPV 2): mohou mít cystickou složku a vzácně typ mozaiky.
Verruca plana
Verruca plana (HPV 3, 10 a někdy 2) jsou drobné měkké papuly průměru 1–4mm, vystupující méně než 1mm nad nivó okolí, tvarů rozeklaných pohoří a údolí, sporuchami pigmentace (bělavé a bledě hnědavé), na krku, tvářích, končetinách, u adolescentů bolestivé. Jsou kosmetickým problémem na nekryté kůži. Převážně provázejí imunologický deficit.
Epidermodysplasia verruciformis
Epidermodysplasia verruciformis může být z 10% důsledkem příbuzenského zplození, na podkladě autozomální recesivní dědičnosti, většinou však provází imunosupresi. Celoživotní chronická infekce kůže viry HPV, podobná seboroické dermatitis, se projevuje od dětství nebo dospívání vpodobě plochých a rudohnědých exofytických papilomů na trupu, končetinách, tvářích i ušních lalůčcích. Vlivem UV záření se zvolna transformují ve 40 až 60 letech věku. Realizovaný verukózní karcinom má slabou tendenci k metastazování, nepostihuje lymfatické cévy ani uzliny. Kožní změny EV nejsou kontaktně přenosné na zdravého člověka. Zatím bylo popsáno jen 195 onemocnění z východní Evropy a Latinské Ameriky [15, 29].
Infekce faryngu a laryngu
HPV infekce jsou příčinou lézí orofaryngu, včetně bradavic; týkají se nejvýše 0,5% lidí, početnější jsou u osob sporuchami imunitní odezvy. Také v této lokalizaci jde o solitární nebo vícečetné exofytické přisedlé nebostopkaté papilomy sverukózními výčnělky až květákovitými výrůstky.
Obávaným onemocněním kojenců, batolat a imunosuprimovaných dospělých je laryngeální papilomatóza, příčina dechových obtíží, zjistitelná laryngoskopií. Vyskytuje se sporadicky u kojenců v důsledku prostupu porodními cestami matky a později ve věku kolem tří let.
Rekurentní respirační papilomatóza u dětí, vzácně u dospělých, začíná chrapotem, pokračuje sípáním, pak dechovými obtížemi a obstrukcí dýchacích cest. Není jiné cesty nežopakované tracheostomie, resekce papilomů, řízená ventilace, adjuvantní farmakoterapie a nepředpověditelný průběh nemoci. Příčinou jsou zdánlivě benigní produktivní léze způsobené podtypy virů HPV 6 a 11. Infekce se může manifestovat i v podobě papilomů nazálních, konjunktiválních, na víčkách očních a v celém aerodigestivním traktu.
Infekce anogenitální oblasti
Analogické změny nastávají i v oblasti anogenitální, kde infekce postihuje jak povrch kůže, tak její adnexa, tj. žlázky ekkrinní i apokrinní (vhluboké dermis svýstelkou z kuboidního epitelu), holokrinní pilosebaceózní aparát v epidermis a folikuly chloupků (ze stratum germinativum epidermis). Exofytické nebo ploché ložiskové změny se zde označují jako kondylomy, od papul až k objemným exofytickým masám tkáňové hyperproliferace. Ty se prezentují také na vrstevnatém dlaždicovém epitelu interiéru vaginy, u muže na glans penis, membru a kůži perigenitálně, perineálně, na sliznici uretry. traktu, avšak s četností jen několika procent počtu změn genitálních.
K infekci virem lidských papilomatózních lézí v anogenitální oblasti dochází především přímou inokulací kontaktem kůže nebo sliznice v místech drobných erozí a v terénu nezralé transformační zóny při sexuálním styku (vaginálním, rektálním, orálním) s infikovaným partnerem. Ochrana kondomem je pro rozsah infekčního osídlení omezeně účinná. Přenos je možný vzácně i vertikálně, z porodních cest matky na dítě, může se projevit někdy i později než za rok. Další možností je přenos viru HPV2 autoinokulací, popř. inokulací od pečující osoby k příjemci při výměně plen a prádla (přenos byl dříve mylně interpretován jako důsledek sexuálního zneužití). HPV infekce jsou tak rozšířené, že až 80% celé populace sexuálně aktivních lidí byla v určitém okamžiku svého života infikována. Jediným rezervoárem infekce HPV je člověk.
Podle pořadí sekvencí nukleotidů je nyní známo 130 odlišných typů virů, znich více než 40 osídluje mužský i ženský anogenitální trakt. Viry indukující karcinogenezi nejsou totožné s viry indukujícími vývoj veruky.
Se zřetelem k možnému onkogennímu působení na cervix uteri patří k virům:
- vysokého rizika (HR-high risk): typy 16, 18, 31, 33, 45 (tři čtvrtiny karcinomů)
- nízkého rizika (LR-low risk): asi 15 typů. zejména 6, 11, 40, 42, 43, 51, 52 aj.
Infekce sama osobě však nezpůsobí maligní transformaci infikované tkáně.
Existují pozoruhodné rozdíly geografické distribuce infekcí HPV děložního hrdla, např. 5× vyšší v subsaharské Africe než v Evropě. Určité typy virů HPV mají afinitu krůzným epiteliálním lokalitám, a také k různým histologickým typům tumorů i jejich prekurzorů: typ 16, 31, 33 k dlaždicobuněčným, typ 18 ke žlázovým (tj. adenokarcinomům).
Průběh infekce HPV může být zcela bezpříznakový. Naprostá většina žen prožívá přechodnou infekci, po níž následuje spontánní clearance virové DNA. Bezpříznakových infekcí je 10–30× více než cytologicky zjistitelných změn.
Condylomata acuminata
Condylomata acuminata (HPV 6 a11, 16, 18 adalší): mukokutánní léze, ploché i exofytické, v podobě ložisek bělajících po chemickém zvýraznění, drsnatin, vlásků aprstíků skapilárními kličkami až ke květákovitým výrůstkům. Kde se na jejich vzniku podílejí typy HPV 16, 18 adalší HR, jsou kondylomy prekurzory karcinomu. Kondylomy mohou současně postihovat perineum, vulvu (vestibulum, zadní manžetu), anální prstenec, vaginu i cervix.
Patogeneze infekce HPV
Infekce vzniká po expozici bazálních epitelií kožního nebo epiteliálního povrchu tělního (keratinocytů) volným virionům. Viry se chovají jako paraziti schopní využívat buněčný biochemický aparát k expresi svých genů k replikaci virových genomů a jejich zabalení do ochranných obalů, to vše v průběhu diferenciačního procesu epiteliálních buněk. Využívají fyziologické deskvamace dlaždicových buněk k šíření svých virionů, bez zánětlivého doprovodu.
K infekci dochází při mikrotraumatech aerozích epitelu endocytózou. Viry adherují vlivem svého povrchového proteinu L1 ke vhodným receptorům na buněčném povrchu, penetrují membránou buněčnou a jsou pohlceny do transportních váčků, které pak splynou sendozomy. Mohly by pak být transportovány do lyzozomů, ale místo toho vlivem svého povrchového proteinu L2 rozruší membránu váčků, putují v cytosolu a ničí vlákna cytoskeletu. V buňkách ztrácejí své proteinové obaly (kapsidy) a jejich kruhová DNA vstupuje do buněčného jádra. Začíná proces exprese virového genomu, výsledkem je protein. Virus kóduje nejprve proteiny, které umožňují hostitelským enzymům rozpoznat a využít jeho replikační počátek, a replikovat tak virový genom, několik málo kopií.
Ty nejsou zatím integrovány, jsou v epizomálním stavu, tj. mimo aktivní hmotu chromozomů, existují v buňce jako plasmidy v podobě monomerických klubíčkových molekul. Virové populace se nezmnoží dělením buněk, protože jsou acelulární, stimulují však lokální proliferaci epitelových buněk [27, 65, 73].
Epitel infikovaný HPV
Proliferace dlaždicového epitelu a její průvodní děj diferenciace do vyzrálé podoby buněk připomínajících střešní krytinu by ostatně probíhala i bez infekce. Jejím růstovým podnětem jsou zejména estrogeny. Vznikají dceřiné kopie bazální buňky, nastává odpoutání od bazální membrány a výstup k povrchu spolu s kondenzací jádra a plošným roztažením cytoplasmy. Celý děj trvá 5–7 dní a diferenciace končí deskvamací z povrchu.
Epitel infikovaný HPV reaguje několika způsoby, nikoli zcela uniformně: ztluštěním (akantózou) nebo rohověním (keratózou), pseudoepiteliomatózní hyperplazií. Při produktivní infekci se v buňkách intermediární vrstvy dlaždicového epitelu replikuje DNA viru HPV a vzniká značné množství kopií (vegetativní amplifikace).
Následně se exprimují proteiny pozdní, kódující vznik kapsid, viry se vážou na membrány malých váčků, vznikají samostatné viriony, chráněné před atakou imunitního systému, a mohou se vyplavit („vypučením") jako exozomy mimo buňku.
Přetrvávající produkci infekčních virionů HPV provázejí cytopatické efekty epiteliálních buněk (aneuploidie a zmnožení jader, vznik keratohyalinních granul a balonovité vakuoly cytoplasmy do podoby koilocytů) a také ložiskové změny epiteliální tkáně – retardace postupu vyzrávání ve vertikálním vrstvení dlaždicového epitelu sexpanzí proliferujících parabazálních elementů, s proměnami krevního řečiště ve stromatu, LSIL (low grade intraepithelial lesions) [55].
Onkogenní potenciál virů HPV
Imunitní reakce je odezvou buněčné složky (humorální reakce je bezvýznamná): infiltrují sem T lymfocyty; rozeznávají antigeny cizích peptidů na povrchu keratinocytů infikovaných molekulami histokompatibilního komplexu HLA a v bradavicích navodí jejich nekrózu včetně okolních buněk a clearance virů HPV. Užití názvu „neoplazie" pro změny LG (low grade lesions) je zavádějící, změny mají tranzitorní ráz a u 90% žen se spontánně zhojí (do dvou let u 81% infikovaných). Klinické problémy vznikají při perzistenci virů HPV v epiteliální tkáni (přetrvávání přítomnosti virové HPV více než 1–2 roky) a integraci virového genomu typu HR do buněčného jádra (kopie seřazené jedna za druhou na zranitelných místech chromozomu).
To vede často ke ztrátě funkce virového proteinu E2, což usnadní imortalizaci buněk. Časné proteiny E6 a E7 virů HPV „vysokého rizika" potlačují (zvýšenou degenerací) hlavního ochránce integrity původního buněčného genomu – tumor-supresorový protein p53 a aktivují enzym telomerázu. E7 jako hlavní transformující onkogen se váže na tumor-supresorovou skupinu buněčných proteinů pRB. To vše stimuluje přechod buňky do S-fáze buněčného cyklu a vede kreplikaci. Oba proteiny jsou onkogeny, imortalizují buňky. Brání normální buněčné reakci, jíž by byla programovaná smrt. Buňka permanentně infikovaná HPV prochází sérií buněčných dělení a není schopna reagovat apoptózou.
Virus přebírá určité kontrolní mechanismy buněčného cyklu a preferuje svou vlastní replikaci. Infikované buňky jsou geneticky nestabilní. Je narušen i průběh mitózy, vznikají proto atypické mitotické figury. Jen tyto ženy mohou mít léze HG (heavy grade lesions), pravé prekurzory možného zvratu v karcinom. Ztrácí se diferenciace, tj. převládají malé bazaloidní buňky i v horní části epitelu, je patrná aneuploidie se zvětšením jader a změnou poměru velikosti jádra k cytoplasmě, s větším počtem mitotických figur, s možností progrese.
Současná terminologie infekce HPV
Názvosloví těchto změn vzešlo z konfrontace prebioptických vyšetřovacích metod (kolposkopie acytologie) s histopatologií (standardem diagnózy) a vyvíjelo se v souladu s poznáním společné příčiny a variant morfologických znaků.
V šedesátých letech minulého století převládaly pojmy dysplazie (lehká, střední a těžká) a karcinom in situ (v naší zemi se dosud často užívají), pak cervikální intraepiteliální neoplazie (CIN1, 2, 3), až k soudobému třídění na low grade intraepithelial lesions (LSIL) a high grade intraepithelial lesions (HSIL). Léze žlázového epitelu GIL (glandular intraepithelial lesions) se nyní označují jako žlázové buněčné atypie (AGC-FN) a adenokarcinom in situ (AIS). Vyvíjejí se v kratším časovém sledu, proto náleží k lézím HG.
Infekce viry HPV obdaří buňky „nesmrtelností", ale nestačí k jejich maligní transformaci. Buněčná imortalizace vyžaduje obnovu délky chromozomálního telomeru aktivací telomerázy. Exprese časného virového proteinu E6 ji pouze indukuje.
Rizikové faktory transformace
Kromě základní predispozice, tj. perzistence virové DNA, jsou známy i další faktory zvyšující relativní riziko neoplastické transformace:
- sexuální chování muže a počet sexuálních partnerů v průběhu života
- etnicky daná genetická predispozice (rozdíly haplotypu leukocytárního antigenu HLA)
- větší počet donošených dětí u mladých žen (trauma cervixu, imunosuprese)
- infekce dalšími sexuálně přenosnými patogeny (některé genotypy chlamydií)
- tabakismus, zvláště kouření cigaret (silné argumenty epidemiologické)
- poruchy imunitní odezvy, zejména imunodeficience, HIV
- počátek kohabitace v době pubertálních somatických změn
- poruchy výživy snízkou hladinou a-tokoferolů a vitaminu C, antioxidantů
- neúčast na screeningových vyhledávacích programech [62, 69, 72]
Léze dlaždicového epitelu úrovně LSIL v naprosté většině případů spontánně regredují nebo dlouhodobě stagnují. Jen u 10% znich dochází k progresi v HSIL, a jen 0,15% progreduje v invazivní karcinom, a to po celkem více než 10 letech od primární infekce (Schiffman HM, 2004).
Léze žlázového epitelu GIL jsou vzácnější (vpoměru ke dlaždicobuněčným 1 : 50), mohou však progredovat rychleji. Přirozený vývoj infekcí HPV je totožný svývojem prekanceróz. I prekancerózní léze HG mohou, byť méně často, spontánně (tj. imunitní reakcí) regredovat a vymizet. Nejzávažnější je perzistence viru HPV 16, jenž zatím blíže nevysvětleným způsobem uniká imunitnímu dozoru.
Řadu let jsou prekancerózní změny přístupné detekci (klinická cytologie, kolposkopie, event. i test přítomnosti HPV DNA) a návazné diagnostice a léčbě. Poslední příčina maligního zvratu, spojená s průnikem, resp. lokální ztrátou způsobilosti tvořit bazální membránu, není známa [15, 26, 35].
Karcinomové buňky jsou výsledkem několika (snad 6–10 i více) mutací, jež se v dlouhém časovém horizontu akumulovaly. Především se množí, rychleji než buňky normální, bez řádu, chaoticky, nezávisle na růstových a mitogenních podnětech a regulacích. Jsou to mutanty, přežívají i za okolností, při nichž by normální buňky prošly apoptózou. Nejsou omezeny degenerací telomerů, jejich genom exprimuje telomerázu. Vzrůstajícími nároky neoplasmatu na kyslík a živiny provokují lokální extracelulární produkci faktorů angiogeneze a později metastazují [3, 26, 28, 60].
Výsledkem jsou čepy neoplastických epiteliálních buněk ve stromatu, pak průnik do krevních cév nebo lymfatických štěrbin, invaze, pak invazivní růst snovotvorbou cév a později tvorba metastáz do okolí nebo ve vzdálených lokalitách, v definovaných klinických stadiích maligního tumoru. Neléčené nemocné způsobí krvácení, špinění, hlenohnisavý fluor, rekurentní cystitis, únavu a slabost, bolesti vzádech i podbřišku, edémy dolních končetin, píštěle nebo obstrukce močových cest, zažívacího traktu, dechové obtíže, anemii a kachexii. Karcinom děložního hrdla je stále vážným zdravotním i zdravotně sociálním problémem v Evropě. Každým rokem je jím postiženo 60 000 žen a z nich cca 30 000 na toto onemocnění umírá. Nové členské země EU mají incidenci onemocnění dvakrát vyšší než země původní EU 15. Týká se to zejména žen na vrcholu života, mezi 30 a 50 lety.
Prekurzory lze odhalit a relativně jednoduchými ambulantními ošetřeními eradikovat. Metody sekundární prevence, tj. screening a následná diagnostika i léčba jsou velmi účinné, avšak organizované programy má jen menšina zemí v Evropě.
Od počátku roku 2008 započal postupnými kroky v České republice národní program screeningu karcinomu děložního hrdla, koncem téhož roku se rozběhla i jeho auditovaná část. Důsledně aplikovaná standardní úroveň dosavadních postupů sekundární prevence a v delším časovém horizontu nyní již dostupná primární prevence vakcinací naznačují cestu, jíž by bylo možno produktivní infekce a většinu karcinomů děložního hrdla i dalších mukózokutánních lokalizací ze seznamu lidských utrpení prakticky vymýtit.
Literatura
- Ajit D, Gavas S, Jagtap S. Chinoy R. Cytodiagnostic problems in cervicovaginal Smears from symptomatic breast cancer patients on tamoxifen therapy. Acta Cytol. 2009;53:383–8.
- Baandrup U, Bishop JW, Bonfiglio TA, et al. Sampling, sampling errors and specimen preparation. Acta Cytol. 2000;44:944–8.
- Baege AC, Berger A, Schlegel R, et al. Cervical epithelial cells transduced with the papillomavirus E6/E7 oncogenes expression. Am J Pathol. 2002;55:1251–7.
- Bubendorf L. Tissue microarrays meet cytopathology. Acta Cytol. 2006;50:121–2.
- Bucholz TJ. January is Cervical Cancer Awareness Month: MDCH Begins Advertising Campaing To Raise Awareness [online]. Document version 2005-01-19 [cit. 2005-03-10]. Dostupný zde >>>
- Castellsagué X. Men's contribution to cervical cancer risk. HPV Today. 2003;3:10–1.
- Castle E. Beyond HPV. J Lower Genital Tract Dis. 2004;8:224–30.
- Celik C, Gezginc K, Toy H, et al. Acomparison of liquid-based cytology with conventional cytology. Int J Gynaecol Obstet. 2008;100:163–6.
- Cervical Cancer Facts [online]. Chicago: American Society for Clinical Pathology, 2004- [cit. 2005-03-09]. Dostupný zde >>>.
- Cervical Cancer Prevention. National Cancer Institute [online]. Last modif. on 20 February 2007 [cit. 2007-06-17]. Dostupný zde >>>.
- Cervical Cancer Screening: The Pap Smear. NIH Consens Staement. 1980;3:1–11.
- Cox JT, Moriarty AT, Castle PE. Statement on HPV DNA Test Utilization – Commentary. Acta Cytol. 2009;53:249–52.
- Dallenbach-Hellweg G, Doebericz MK, Trunk MJ. Color Atlas of Histopathology of the Cervix Uteri. 2nd ed. Berlin: Springer; 2006.
- Dalton P, MacDonald S, Boerner S. Acetic acid recovery of gynecologic liquid-based samples of apparent low squamous cellularity. Acta Cytol. 2006;50:136–40.
- DeVilliers EM, Fauquet C, Broker TR, et al. Classification of papillomaviruses. Virology. 2004;324:17–27.
- Dušek L, Dvořák V, Chroust K, et al. Epidemiologie karcinomu děložního hrdla vČeské republice. Dostupný zde >>>.
- Doporučení ČGPS kočkování proti HPV ze dne 23.3.2007. Zpravodaj SSG. 2007:9.
- Dvořák V, Ondruš J. Vakcinace proti HPV vČR. Farmakoterapie 2007;3:285–6.
- Dvořák V, Ondruš J. Kategorie ASC, AGC vgynekologické cytologii. Moderní gynekologie aporodnictví. 2007;16(2):289–94.
- Dvořák V, Ondruš J. Nové perspektivy prevence rakoviny děložního hrdla. Prakt Gyn. 2006;10(5):198.
- Dvořák V, Ondruš J. Screening karcinomu děložního hrdla – současný stav. Česk. gynek. 2010;75(1):65–8.
- Evropská společnost gynekologické onkologie ESGO: Vyjádření kočkování proti karcinomu děložního hrdla. Gynekologie po promoci. 2007;7:67.
- Fait T. Kvadrivalentní vakcína proti HPV. Farmakoterapie. 2007;5:467–70.
- Farag R, Redline R, Abdul-Karim FW. Value of combining HPV-DNA testing with follow-up Papanicolaou Smear in patients with prior atypical squamous cells of undetermined significance. Acta Cytol. 2008;3(52):294–6.
- Ferris DG, Cox JT, O'Connor DH, et al. Modern Colposcopy. 2nd ed. Iowa: Kendall/Hunt Publishing Company; 2004.
- Fu YS, Hilborne LH. Human Papillomavirus Infections. Elsevier; 1989.(2). p.156–7.
- Gravitt P.HPV: the ultimate cancer initiator? HPV Today. 2003:8–9.
- Guijon FB. Field HPV infections, aclinical dilemma. HPV Today. 2003;3:3.
- Guo M, Sneige N, Silva EG. Distribution and viral load of eight oncogenic types of human papilomavirus (HPV) and HPV 16 integration status in cervival intraepirhelial neoplasia and carcinoma. Mod Pathol. 2006.
- Hachisuga T, Emoto M, Kawarabayashi T. Endometrial cytologic findings in tamoxifen-treated breast cancer patients. Acta Cytol. 2009;53:24–8.
- Hakama M. Effect of population screening for carcinoma of the uterine cervix in Finland. Maturitas. 1985;7:3–10.
- Halada P, KřepinskáE. HPV vakcina: začátek konce karcinomu děložního čípku? Gynekolog. 2007;16:34–6.
- Halder K, Chachra KL, Sodhani P, Gupta S. Utility of imprint cytology for early presumptive diagnosis in clinically suspicious cervical cancer. Acta Cytol. 2008;52(3):286–93.
- Hamšíková E. Imunologie papillomavirů. Moderní gynekologie aporodnictví. 2006;15(Suppl A):595–9.
- Hamříková E, Tachezy R. Afekce HPV – epidemiologické aklinické souvislosti. Farmakoterapie. 2007:4–6.
- HPV Disease – Clinical Manifestations of HPV. In: MerckMedicus Modules [online]. USA: Merck&Co., 2001–2009. Last modif. on July 2006 [cit. 2009-11-11]. Dostupný zde >>> .
- HPV Disease – Definition. In: MerckMedicus Modules [online]. USA: Merck&Co., 2001 – 2009. Last modif. on July 2006 [cit. 2009-11-11]. Dostupný zde >>>.
- HPV Disease – Natural History. In: MerckMedicus Modules [online]. USA: Merck&Co., 2001–2009. Last modif. on July 2006 [cit. 2009-11-11]. Dostupný zde >>>.
- Chlíbek R. Imunogenita vakcín proti lidskému papilomaviru. Vakcinologie. 2008;2:145–53.
- IARC Working Group on Evaluation of Cervical cancer Screening Programmes: Screening for squamous cervical cancer: duration of low risk after negative results of cervical cytology and its implications for screening policies. Br Med J. 1986;293:659–64.
- Iwahashi M, Muragaki Y, Ooshima A, Umesaki N. Decreased type Icollagen expression in human uterine cervix during pregnancy. J Clin Endocrinol Metab. 2003;88:2231–5.
- Jones E, McGahey Frain B, Crabtree W. Clinical significance of reporting benign-appearing endometrial cells in Pap tests in women aged 40 years and over. Acta Cytol. 2009;53:18–23.
- Joura EA, Kjaer SK, Wheeler CM, et al. HPV antibody levels and clinical efficacy following administration of aprophylactic quadrivalent HPV vaccine. Vaccine. 2008;52:6844–51.
- Kahn JA. Očkování proti HPV vrámci prevence cervikální intraepiteliální neoplazie. Gynekologie po promoci. 2009;září/říjen:4–10.
- King MD, Reznik DA, O'Daniels ChM, et al. Human papillomavirus-associated oral warts among human immunodeficiency virus-seropositive patients in the era of highly active antiretroviral therapy: An emerging infection. Clin Infect Dis. 2002;34:641–8.
- Kirchner JT, Emmert DH. Sexuálně přenosné nemoci užen. Infekce způsobované bakterií Chlamydia trachomatis avirem herpes simplex. Medicína po promoci. 2000;3:53–9.
- Klomp JM, Ouwerkerk-Noordam E, Boon ME. Gardnerella infection as distinguished from cervical dysbacteriosis: the advantageous spin-off of cervical screening. Acta Cytol. 2009;53:389–95.
- Kobilková J, Beková A, Janoušek M, Strunová M. Výsledky pokusů osnížení incidence rakoviny cervixu. Prakt Gyn. 2006;10(5):186–9.
- Koss LG, Durfee GR.Unusual patterns of squamous epithelium of the uterine cervix: cytologic and pathologic study of koilocytic atypia. Ann NY Acad Sci. 1956;63:1245–61.
- Koutsky L. Evaluation of aprophylactic HPV vaccine shows great protection against HPV infections. HPV Today. 2003;3:1–3.
- Lai ChR, Hsu CY, Tsay SH, Li AFY. Clinical significance of atypical glandular cells by the 2001 Bethesda System in cytohistologic correlation. Acta Cytol. 2008;52:563–7.
- Lee CY, Ng WK. Follow-up wtudy of atypical glandular cells in gynecologic cytology using conventional Pap smears and liquid-based preparations: impact of the Bethesda System 2001. Acta Cytol. 2008;52:159–68.
- Lee BCK, Lam SY, Walker T. Comparison of false negative rates between 100% rapid review and 10% random full rescreening as internal quality control methods in cervical cytology screening. Acta Cytol. 2009;53:271–6.
- Maccallini V, Angeloni C, Caraceni D. Comparison on the conventional cervical smear and liquid-based cytology. Acta Cytol. 2008;52:568–74.
- Meisels A, Fortin R, Roy M. Condylomatous lesions of the cervix. II. Cytologic, colposcopic and histopathologic study. Acta Cytol. 1976;20:483–5.
- Mikyšková I, Dvořák V, Michal M. Lidské papilomaviry jako příčina vzniku gynekologických onemocnění. Prakt Gyn. 2003;4:33–6.
- Miller AB, Anderson G, Brisson ,. et al. Report of anational workshop on screening for cancer of the cervix. Can Med Assoc J. 1991;145:1301–25.
- Mokhtar G, Roustan Delatour NLD, Assiri AH, et al. Atypical squamous cells, cannot exclude high-grade squamous intraepithelial lesion. Acta Cytol. 2008;52:169–77.
- Morrison BJ. Screening for cervical cancer. Canada: Canada Communication Group. 1994;73:883–9.
- Motoyama S, Ladines-Llave CA, et al. The role of HPV in molecular biology of cervical carcinogenesis. Kobe J Med Sci. 2004;50:9–19.
- Mumba E, Ali H, Turton D, et al. Human papillomavirus do not play an aetiological role in Müllerian adenosarcomas of the uterine cervix. J Clin Pathol. 2008;61:1041–4.
- Munos N, Bosch FX, de Sanjose S, et al. Epidemiological classification of human papillomavirus types associated with cervical cancer. N Engl J Med. 2003;348:518–27.
- Münger K, Balšán A, Edwards KM, et al. Mechanism of human papillomavirus-induced oncogenesis. J Virol. 2004;78:11451–60.
- Naylor M. Cutaneous Human Papillomavirus Infections [online]. The Electronic Textbook of Dermatology. The Internet Dermatology Society, Inc. [cit. 2006-12-30]. Dostupný zde >>>.
- Nyklíček O. Historie výzkumu lidského papilomaviru vsouvislosti skarcinomem děložního čípku. Gynekolog, 1996;4.
- Ondruš J, Dvořák V. Screening karcinomu děložního hrdla – teoretické předpoklady. Česk. Gynek. 2010;75(1):62–5.
- Padberg BCh, Bode B, Zimmermann DR.Metastatic warty (condylomatous) carcinoma of the uterine cervix associated with low-risk HPV Type 6. Acta Cytol. 2006;50:235–8.
- Pacheco MC, Conley RC, Pennington DW, Bishop JW. Concordance between original screening and final diagnosis using imager vs. manual screen of cervical liquid-based cytology slides. Acta Cytol. 2008;52:575–8.
- Peterson IM, Rao R. Genital warts: newly discovered consequences of an ancient disease. Postgraduate Medicine. 1989;86(3):197–204.
- Pilka R, Rokyta Z. Prevalence ageografická distribuce HPV-infekce: Víme proti čemu budeme očkovat? Prakt Gyn. 2006;4:145–6.
- Pluta M. HPV vakcina. Moderní gynekologie aporodnictví. 2006;15(Suppl A):609–16.
- Pluta M, Rob L, Robová H, Kačírek J. Onemocnění spojená sinfekcí humánním papilomavirem. Farmakoterapie. 2007;5:529–32.
- Prendiville W, Davies P.HPV Handbook 1. Papillomavirus and Cervical Cancer. The European Consortium for Cervical Cancer Education. London:.Taylor and Francis; 2004.
- Repše-Fokter A, Čakš-Golec T. Rapid prescreening as aquality assurance measure in cervical cytology. Acta Cytol. 2009;53:268–70.
- Richart RM, Cox JT, Twiggs LB, et al. Zásadní změny vdiagnostice amanagementu HPV acervikální patologie – část II. Gynekologie po promoci. 2003; červenec/srpen:7–15.
- Rob L. Screening karcinomu děložního hrdla vtěhotenství. Komentář. Gynekologie po promoci. 2008;září/říjen:28–30.
- Rob L. Zásadní změny vdiagnostice amanagementu HPV acervikální patologie – část II. Komentář. Gynekologie po promoci. 2003;červenec/srpen:15–6.
- Rob L. Lidský papilomavirus akarcinom děložního hrdla. Komentář. Gynekologie po promoci. 2001;červenec/srpen:68–9.
- Semen may fuel cervical cancer [online]. BBC News. Published: 2006-08-31 [cit. 2009-07-30]. Dostupný na: http://news.bbc.co.uk/go/pr/fr/-/2/hi/health/5303054.stm.
- Sláma J, Freitag P.Vakciny proti lidským papilomavirům. Prakt Gyn. 2007;1:3–4.
- Solomon D, Papillo JL, Davey DD, et al. Statement on HPV DNA test utilization. Acta Cytol. 2009;53:247–8.
- Southern SA, Herrington CS. Molecular events in uterine cervical cancer. Sex Transm Inf. 1998;74:101–9.
- Stanley M. HPV, amaster of evading the host defences. HPV Today. 2007;11:3–4.
- Stebbing J, Gazzard B. Virus host interactions. Obstet Gynaecol. 2003;5:103–6.
- Steinman S, Smith D, Chandler N, et al. Morphologic, patient and interpreter profiles of high-risk human papillomsvirus-positive vs. negative cases of atypical squamous cells of undetermined significance. Acta Cytol. 2008;52(3):279–85.
- Svoboda J. Retroviry vsoučinnosti ivsouboji sbuňkou. Vesmír. 2008;87:303–5.
- Task Force controved by the Department of National health and Welfare. cervical cancer screening programs: summary of the 1982 Canadian task force report. Can Med Assoc J. 1982;127:581–9.
- Task Force on Cervical Cancer Screening Programs: Cervical cancer screening programs. Can Med Assoc J. 1976;114:1003–33.
- Derkay CS, Wiatrak B. Recurrent respiratory papillomatosis: areview.Laryngoscope. 2008;118:1236–47.
- U.S. Preventive Services Task Force: Guide to Clinical Preventive Services: an Assessment of the Effectiveness of 169 Interventions. Baltimore, Md: Williams & Wilkins; 1989. p.57–62.
- van Doorn HC, Opmeer BC, Kooi GS, et al. Value of cervical cytology in diagnosing endometrial carcinoma in women with postmenopausal bleeding. Acta Cytol. 2009;53:277–82.
- Voss JS, Kipp BR, Campion MB. Comparison of fluorescence in situ hybridization, hybrid capture 2 and polymerase chain reaction for the detection of high-risk human papillomavirus in cervical cytology specimens. Anal Quant Cytol Histol. 2009;31:208–16.
- Waxman AG. New cervical cancer screening guidelines: Do they signal the end of the annual pap test? J Low Genit Tract Dis. 2004;8(2):87–90.
- Waxman AG, Zsemlye MM. Screening karcinomu děložního hrdla vtěhotenství. Podle nejnovějších doporučení ASCCP. Gynekologie po promoci. 2008;září/říjen:24–7.
- Wright TC, Goldie SJ. Screening for cervical cancer - technical comments. Science. 2000;290:1651.
- Yildiz IZ, Usubütün A, Firat P, et al. Efficiency of immunohistochemical p16 expression and HPV typing in cervical squamous intraepithelial lesion grading and review of the p16 literature. Pathol Res Pract. 2007;203:445–9.
- Young NA. The declining pap test: an omen of extinction or an ppportunity for reform? Acta Cytol. 2008;52:277–8.
- Yuan Q, Wilbur DC. Original cervical cytology and follow-up biopsy results in positive high risk human papillomavirus DNA tests with high-level esults. Acta Cytol. 2008;52:557–62.
- Zuna RE, Allen RA, Moore WE. Comparison of human papilomavirus genotypes in high-grade squamous intraepithelial lesions and invasive cervical carcinoma: evidence for differences in biologic potential of precursor lesions. Mod Pathol. 2004;11:1314–22.
- Žaloudík J, Vyzula R. Preventivní onkologické prohlídky jinak aneb nová koncepce věkově specifické, individualizované sekundární onkologické prevence. Zdravotnické noviny [publikováno dne: 2002-05-17].
