Léze HSIL
Léze HSIL (high grade intraepithelial lesions) jsou bezpříznakové a pro nekompetentního pozorovatele neviditelné. Přitom mají signifikantní onkogenní potenciál: až polovina neléčených HSIL může progredovat v invazivní karcinom, proto histologicky verifikované léze je nutno eradikovat. Změny jsou důsledkem perzistence HR typů HPV, při nichž je virová DNA integrována do genomu hostitele (aktivních částí chromozomů buněčných jader; obr. 160, 161).
Léze HSIL jsou charakterizovány čtyřmi prvky, všechny musí být přítomny pro diagnózu:
- ztráta diferenciace
- dezorganizace epitelu
- značná atypie buněk
- přítomnost mitóz i v horní polovině krycího epitelu [20, 27, 43]
1. Ztráta diferenciace
Normální cervikální dlaždicový epitel sestává z jedné vrstvy bazálních buněk (tmavá jádra s dlouhou osou kolmo na bazální membránu) a malého množství cytoplasmy, parabazální vrstvy 2–3 buněk schopných proliferace v estrogenizovaném terénu, keratinocytů intermediárních s mezibuněčnými můstky a glykogenem v cytoplasmě. Superficiální keratinocyty jsou oploštělé a mají malá pyknotická jádra. Při lézích HG jsou i ve vnější polovině epitelu bazaloidní buňky, z toho při CIN2 jen s ložiskovým vyzráváním, při CIN3 bez něj. Prognosticky nepříznivé jsou větší okrsky postiženého epitelu a hlubších endocervikálních žlázových krypt a v jejich luminu nekróza. Přibližně 1–7 % lézí je sdruženo s invazí, 10–20 % neléčených progreduje v karcinom.
2. Dezorganizace nebo anarchie epitelu
Jde o kombinaci nahloučení jader a ztráty polarity epiteliálních buněk nejen ve vztahu k bazální membráně, ale také mezi buňkami navzájem. Epitel je vysoce buněčný a dezorganizovaný, popř. s povrchovou parakeratózou, noří se nezřídka hlubokými čepy do podložního stromatu a do ústí žlázových krypt. V celém okrsku kolposkopicky viditelné léze mohou být přítomny i okrsky LSIL.
3. Výrazné buněčné atypie
Jádra jsou markantně zvětšená, zaujímají nejméně dvě třetiny plošné projekce buňky a cytoplasmy je jen málo. Jádra jsou pleomorfní, hyperchromatická a nepravidelná, chromatin s hrubými shluky, zvětšená nepravidelná jadérka jsou ponejvíce překryta hypechromním chromatinem. Celé buňky mohou mít bizarní tvary nebo velikost.
4. Mitotická aktivita
Zvýšená s četnými mitotickými figurami ve všech vrstvách, mnohé mitotické figury jsou atypické.
Dalšími vlastnostmi HSIL jsou:
5. Biologické markery
Léze se pozitivně barví na p16INK4, MIB1 a také na Ki-67 (viz kap. IX).
6. Ztráta buněčné koheze
V elektronové mikroskopii je patrná ztráta soudržnosti (buněčné koheze) pro úbytek desmozomů, ztráta pseudopodií na buněčném povrchu.
7. Histopatologické rozlišení
Histopatologicky je účelné rozlišovat HSIL s dlaždicobuněčnou diferenciací (vzniká na hranicích epitelů, obvykle pokryta atypickou parakeratózou, bez větších protruzí do podložního stromatu) a HSIL s diferenciací rezervních buněk (vzniká spíše proximálně od transformační zóny, v důsledku dvojího potenciálu rezervních buněk i s náznaky hlenotvorných mucinózních formací, papilárních struktur, často s tripolárními mitózami a s hlubokými protruzemi do stromatu), u mladších žen s tendencí k recidivám (obr. 162) [9, 17, 19, 21, 40, 43].
Diferenciálně diagnostické protějšky
Hlavními diferenciálně diagnostickými protějšky jsou:
reaktivní změny (spongióza, izokaryóza, prominující jadérka, ale žádná hyperchromazie)
nezralá dlaždicobuněčná metaplazie (kapky mucinu, leukocytóza, zbytky cylindrického epitelu, izokaryóza, žádná hyperchromazie)
atrofie (hyperchromatická, ale uniformní jádra, elongované buňky, minimální atypie, žádné mitózy) MIB1 negativní, Ki-67 negativní, p16 negativní
postaktinické změny: makrocytóza, vakuolizace, hyperchromazie s rozmazanou strukturou jader, uniformní projasnění jader, normální poměr N/C a mitotická aktivita
uroteliální hyperplazie
účinek jodového roztoku: svraštění, eozinofilie cytoplasmy, vakuolizace a pyknózy [9, 40]
Varianty SIL cervixu
Keratinizující HSIL: pleomorfní a hyperchromatická jádra, keratinohyalinní granula v cytoplasmě (obr. 163).
HSIL s nezralou metaplastickou diferenciací: nezralé ploché léze – malé buňky uniformní populace s redukovaným vyzráváním, zvýšená hustota jader na povrchu s hyperchromazií (obr. 164).
HSIL s eozinofilní dysplazií: asi 10 % lézí, navazuje na infekci HPV. Buňky na rozdíl od klasické HSIL mají hojnou eozinofilní cytoplasmu, zřetelné okraje, zvýšený poměr N/C a ložiskovitě dysplastická zvětšená jádra, s různostmi jaderných lemů a zřetelnými jadérky. Pozitivní p16, MIB1 exprese, HPV. Přítomnost atypických mitóz sama o sobě není určujícím znakem pro vyšší stupeň SIL.
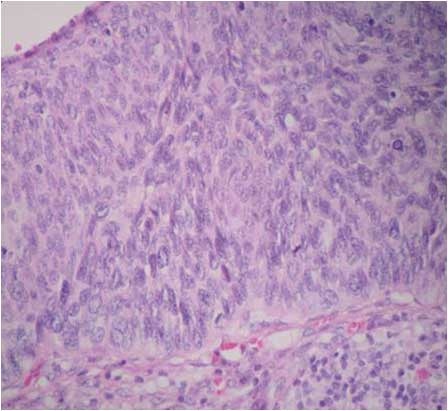
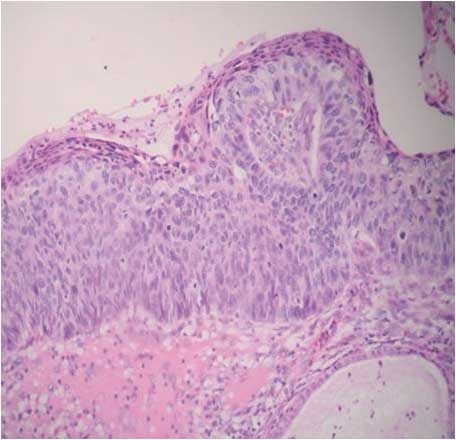
Koilocytóza sama o sobě nestačí pro diagnózu infekce HPV, neboť bývá zaměňována s glykogenizací keratinocytů (pseudokoilocytóza). Je nutno zohlednit i nález cytologický a přikrajovat bioptický materiál při větší diskrepanci (např. LSIL při stěru HSIL). V cytologických stěrech jsou buňky CIN3 v syncytiích s nepravidelnými nebo nezřetelnými okraji a s překrýváním jader nebo tvoří koktejl buněk různého stupně dysplastických proměn (ty bývají eozinofilní). Jsou relativně malé jako při nezralé dlaždicobuněčné metaplazii a jejich jádra jsou téměř stejně velká jako při LSIL. Poměr N/C je významně narušen ve prospěch jader, z nichž některá mohou vyhlížet i jako jádra holá (ve větším zvětšení však diagnostikovatelná jen se zbytkem cyanofilní, vulnerabilní cytoplasmy). Jádra ponejvíce okrouhlá mívají vrypy a záhyby, nestejnoměrné lemy a hrubou uzlovitou strukturu hyperchromního chromatinu s chromocentry – „nepravými jadérky". Pravá jadérka bývají v chromatinovém vzorci skrytá (překrytá hyperchromazií) [9, 17, 19, 43]. Asi 80 % lézí CIN3 koexistuje s jinými dysplastickými proměnami, které jsou zpravidla lokalizovány distálně od nejzávažnějšího okrsku, častěji na více sexuálně traumatizovaném předním pysku ektocervixu, ale stále uvnitř transformační zóny.
Epiteliální abnormality jsou zřejmě multifokální a vyjadřují přítomnost různých buněčných klonů. Téměř v 70 % bývají přidruženy i atypie cylindrického žlázového epitelu, výjimečně až ve stupni adenokarcinomu in situ (možná jen v důsledku větší senzitivity screeningu a navazující diagnostiky).
Změny HSIL zjištěné v graviditě jsou obdobné jako u netěhotných a v pokračující graviditě se někdy i zmírňují. Po porodu léze někdy regredují (v důsledku zhojení porodních traumat a vzhledem k dramatickým proměnám hladin gonadálních steroidů) [9, 15, 32].
Léze HSIL v postmenopauze
Léze HSIL v postmenopauze se zjišťují méně snadno a diferenciální diagnostiku umožňuje jednoduchý a krátkodobý estrogenní test. Deprivace estrogenů redukuje tloušťku vrstevnatého dlaždicového epitelu, absenci glykogenu, snížení vaskularity stromatu a produkci cervikálního hlenu. Objem cervixu se zmenšuje a skvamokolumnární junkce retrahuje směrem do endocervixu. Cytologicky jsou u žen v postmenopauze léze LSIL stěží detegovatelné, protože exfoliace buněk je snížená, ale eventuální progrese je pomalá a lze ji vyloučit v opakovaných stěrech. Stěry jsou často nereprezentativní, s absencí endocervikální složky, a mívají zánětlivé pozadí. Cytoplasma dlaždicových buněk je často eozinofilní s jadernou pyknózou a karyorexí. Převažují parabazální buňky, buněčná koheze a artefakty zaschnutí před fixací preparátu. Nezřídka lze nalézt dyskaryózy, které mohou pocházet z léze z endocervixu, endometria, tub nebo ovarií. Zvláštní pozornost si žádá nález psamomatózních tělísek [25]. (Buňky endometriálního karcinomu někdy nelze odlišit od karcinomuendocervikálního. Buňky třírozměrných agregátů na čistém pozadí mají být podnětem k vyšetření eventuálních extrauterinních karcinomů, zvláště ovariálních.)
Kolposkopie žen v postmenopauze je zatížena subjektivitou vyšetřujícího, umožňuje však cílené biopsie.
Selhává v případech, kdy není možná vizualizace celé transformační zóny, kvůli krvácení, chybnou interpretací léze a spoléháním na cévní atypie. Cervix bývá bledý, stěží reaguje na aplikaci roztoku kyseliny octové, po Lugolově roztoku je světle žlutý. Zavedení spekul snadno navodí krvácení, malé okrsky CIN mohou být seškrábnuty a exponován je okrsek obnaženého stromatu. Žlázový epitel je vyhlazený a papily vzácné. U 60 % pacientek starších 50 let bývá transformační zóna retrahována do endocervixu.
Popsané změny lze zvrátit krátkodobou aplikací estrogenů (estrogenní a gestagenní receptory buněk cervikálního epitelu).
Cartier doporučil (1993) perorální ethinylestradiol 25 µg po 7 dní, což se osvědčilo jako dostatečné pro vyzrání dlaždicového epitelu, které odliší lézi od atrofických změn. Ústup je pak rychlý, kontrolu je třeba provést do 3 dnů po ukončení testu.
Při dnešních možnostech různých aplikačních forem se osvědčila vaginální aplikaceneoponovaných estrogenů, postačí dle zkušenosti autora odstup do 3 dnů od ukončení medikace [25].
Minibiopsie (punch biopsy) se provádí klíšťkami Tischler-Morgan nebo konchotomem, Cartier používal malou kličku tvaru čtverce z drátku tloušťky 0,2 mm, ale s následnou karbonizací resekční linie 0,1 mm [30].
Histologicky je v situaci atrofie sliznic v endocervixu často rozsáhlá hyperplazie rezervních buněk anebo tzv. tranzitivní metaplazie, protože připomíná urotel, jde však ve skutečnosti o variantu hyperplazie bazálních buněk; nejsou v ní buňky tvaru deštníku a má jiný imunohistochemický profil, je negativní pro barvení p16INK4 [17]. Atrofii lze mylně považovat za CIN3 a někdy nezbývá než označit lézi za CIN blíže neurčenou [9, 18, 22].
Excizní technika ošetření je zatížena větším počtem perzistencí léze v endocervixu, proto je žádoucí vyšetřování i operační výkon po přípravě estrogeny.
V postmenopauze je častější další patologie dělohy, jež si vynutí hysterektomii. Před operací je nutné kolposkopické vyšetření k vyloučení invazivního karcinomu hrdla a event. přesahu transformační zóny na stěny poševní.
Změny dlaždicového epitelu, které působí nesnáze cytologie
Jde o heterogenní skupinu lézí, které mohou a nemusejí koexistovat se změnami HPV:
A. Zánětlivé atypie s menšími cytologickými abnormalitami, za značné zánětlivé reakce stromatu, přítomnosti zánětlivých elementů a spongiózy. Může tu být zvýšená mitotická aktivita, ale není porucha diferenciace a organizace epitelu.
B. Hyperplazie bazálních buněk: bazaloidní buňky jsou nad úrovní bazální vrstvy a mohou být i v horní polovině epitelu. Je tu zvýšená mitotická aktivita, ale na rozdíl od HSIL není anaplazie ani cytologická atypie.
C. Nezralá dlaždicobuněčná metaplazie má velmi variabilní morfologii. Jak říká název, jde o neúplnou diferenciaci. Mohou tu být bazaloidní buňky a mitotické figury i v horní polovině epitelu, ale není buněčná pleomorfie. Polarita buněk ve vztahu mezi sebou navzájem je dobře zachována. Zbytky cylindrických žlázových buněk mohou překrývat metaplastický epitel nebo vystýlat lumina žlázových krypt kolonizovaných metaplastickým epitelem.
D. Atrofický dlaždicový epitel nejeví jednoznačnou diferenciaci a může sestávat z buněk s hyperchromatickými jádry i prominujícími jadérky, jež imitují atypie. Není tu však dezorganizace epitelu ani mitotická aktivita (viz výše).
E. Postradiační (postaktinická) dysplazie vzniká za 6 až 20 let po aktinoterapii a má morfologii totožnou s lézemi SIL. Její biologický význam je nejistý [17, 27, 37, 43].
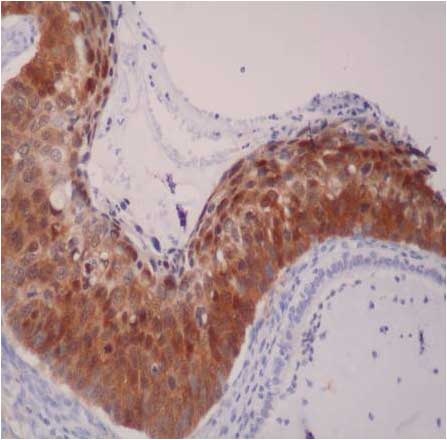
Obecně platí v imunohistochemii, že s narůstající atypií epiteliálních buněčných jader, způsobenou infekcí HR HPV, konkrétně deliberací onkogenu E7, narůstá i exprese p16 (pozitivita s monoklonální protilátkou p16INK4a. Zbarvit se může i cytoplasma, opět více při HSIL než při lézích LSIL (obr. 167).

Obr. 167 Histochemické znázornění léze HSIL (CIN3) při nadměrné expresi p16 (tzv. karcinom in situ z rezervních buněk). Snímek MUDr. V. Hořava jr., se svolením
Nejlepší výsledky skýtají preparáty fixované jinak než formalinem (např. BoonFix), centrifugované ze zbytku LBC cytologie, histologicky zpracované v parafinových blocích.
Vývoj lézí HSIL v čase
Regrese lézí HSIL
Po desetiletích studií přirozeného vývoje (léčbou neovlivněných) lézí HSIL je jisté, že mohou v krátkém i delším časovém horizontu regredovat, také snad v důsledku minimálního traumatu, způsobeného např. biopsií, nebo dokonce i řádně provedeného cytologického stěru (Schillerova Abschabung), pokud zaujímaly malý okrsek. K regresi dochází také v důsledku traumatického efektu porodního děje.
Biologie léze může být alterována různými způsoby: pokud byla léze seriózně detegována, cytologicky a při pozdějším stěru se již neprojeví, neznamená tato změna stavu nutně regresi. Biopsie se tu může uplatnit buď úplnou exstirpací, nebo nepřímo změnou ekvilibria mezi hostitelem a neoplazií (a následnou regresí). Při studiích vývoje biopticky ověřených změn mohou být spontánní regrese nadhodnoceny právě tímto vlivem.
Perzistence lézí HSIL
Jinou alternativou přirozeného vývoje lézí HSIL je jejich perzistence. Byly dokumentovány i případy perzistence beze změny po dobu 20 let a bez další progrese.
Progrese lézí HSIL
Naproti tomu je prokázáno, že některé léze progredují k invazivnímu karcinomu (snad vznikem jiné neoplazie de novo), a to nejméně 10× častěji k HSIL než LSIL.
Ani klinická, ani cytologická, ani histologická data nedovolují predikci zvratu v invazi či naopak tendenci k regresi. Léze HSIL jsou však obecně přijímány jako pravé prekurzory karcinomu.
Téměř všechny dysplastické léze jsou spojeny s přítomností HPV DNA HR. Protože však je virová infekce nebo setkání s ní údělem naprosté většiny žen i mužů v populaci dospělých v reprodukčním věku, není průkaz virové DNA sám o sobě relevantní pro prognózu potenciálu léze k progresi, a údaj o náloži, tedy kvantifikace nálezu DNA nebo její indexace, jsou pro stanovení prognózy bezcenné. (Lze očekávat přínos stanovení exprese virových onkogenů E6/E7 a metod molekulární biologie.) [8, 12, 23, 28].
Ani skutečnost polyploidie chromozomů některých buněk intraepiteliálních neoplazií (a stejně tak mikroinvazivních či invazivních karcinomů), kterou lze stanovit měřením (průtoková cytometrie – fow cytometry), není vodítkem k rozlišení těchto stavů (Atkin - 4). Zdá se však, že aneuploidie u lézí CIN3 u žen mladších 35 let je jiná a méně frekventovaná (27 %) než u žen starších (až 88 % po 50. roce věku).
Progrese k invazi mohou tedy mít různé biologické charakteristiky a normální diploidní vzorec DNA není zárukou regrese nebo alespoň neinvazivní perzistence lézí HSIL (Atkin - 5, Hanselaar - 61) [9, 21, 37].
Konsenzus expertů ČR v r. 2008 přijal odborné doporučení: cytologický nález HSIL je indikací k základní nebo expertní kolposkopii.
Není-li shoda obou prebioptických metod, je indikována kolposkopie expertní nebo cílená minibiopsie.
Pokud kolposkopie nalézá rovněž HSIL, je indikována excize metodou přiměřenou atypické transformační zóně, a není-li patrná hranice epitelů, včetně kyretáže (nebo brush) nad úrovní excize.
Kolposkopie HSIL
Kolposkopie HSIL má, jako ostatně vždy, prvořadý úkol vyloučit známky invaze nebo dokumentovat, že v tom směru není dostačující, protože nelze dohlédnout proximální hranici epitelů (skvamokolumnární junkci).
Teprve pak se kolposkopující zabývá základní premisou: nalézt nejvíce abnormální okrsek pro cílenou biopsii. Protokol úvahy se má řídit schématem, jež vyjadřují skórovací systémy, popis však má být individualizován.
Nalézt okrsek nejzávažnější změny je důležitější než předpověď histopatologie.
Současně nelze opomíjet jiné klíčové faktory lokalizace léze:
Léze HSIL jsou obvykle uvnitř transformační zóny, a to při jejím proximálním okraji, a mohou přesahovat do endocervixu. Většinou jsou solitární a mohou se vyskytovat v okrsku LSIL (tzv. léze v lézi). Mohou mít různý plošný rozsah, obvykle v souladu se závažností a rizikem okultní invaze (a také s rizikem neúspěchu léčebného výkonu).
Barevný tón léze, růžový nebo rudě červený (vaskularizace stromatu), je dobře patrný po šetrné evakuaci hlenu fyziologickým roztokem a pozoruje se nativně a se zeleným filtrem po aplikaci roztoku octové kyseliny tak, aby nedošlo k arteficiálním erozím (epitel HSIL má menší adhezivitu ke spodině a snadno se odloupne). Zbělání (blok světelného odrazu cév) zvýrazní okrsky ztluštění epitelu, jeho zvýšenou buněčnost, zmnožení jaderné hmoty a produkci keratinu.
Léze HSIL jsou špinavě bílé a matné, perleťové, připomínají vnitřní plochu lastur. Okraje jsou ostře zřetelné, s přímými konturami, nebo zaúhlené, a to i uvnitř větších okrsků LSIL (jejichž okraje jsou nezřetelné nebo zpeřené). Tato vlastnost (léze v lézi) je spojena se snadným odloupáváním (peeling) ve svitcích, vznikají eroze až mělké ulcerace.
Zbělání je jiné než u LSIL, vzniká promptně, je spíše matné, šedobílé, dlouho přetrvává.
Jemné sítě kapilár pod normálním epitelem a jemné cévní vzorce M a P v okrscích normální transformační zóny, a pravidelné při LSIL, již nejsou patrné.
Zbývají nestejnoměrné, hrubé vzorce mozaiky nebo tečkování, patrné i při malém zvětšení, v důsledku komprese a dilatace cév s rychle pučícím epitelem, mění se s nástupem a odeznívajícím účinkem roztoku kyseliny octové. Zpočátku mohou překrývat i zbělání, pak vyblednou. Lézi je nutno sledovat a méně zřetelnou bělobu nepřehlédnout (přirozenou tendencí směřování oka ke křídové běli periferní LSIL).
Kombinace znaků M+ (umbilicated mozaic) svědčí pro HSIL charakteru CIN3.
Interkapilární vzdálenost mezi P nebo velikost políček M jsou morfometricky měřitelné. V normálním epitelu je vzdálenost kolem 100 µm, při lézích LSIL méně než 250 µm, v lézích HSIL větší. Studie event. zvýšené přítomnosti faktorů angiogeneze, zvláště VEGF, byly neprůkazné [24]. Nelze tedy předpokládat podíl neoangiogeneze na vzniku cévních obrazců provázejících premaligní léze, cévy normální provenience jsou stlačovány pučením epitelu. Cévní atypie z této příčiny jsou až součástí kolposkopických obrazů invazivního karcinomu.
Původně sledovaný parametr ztluštění epitelu byl včleněn do popisu okrajů.
Protože léze postihují i žlázové krypty, bývají jejich ústí konturovaná (rimmed glands) nebo lemovaná (cuffed glands). Aplikace Lugolova roztoku nepřináší zvláštní hodnotu, léze HSIL jsou výrazně jodnegativní, znázorní se hořčicovou žlutí nebo jsou jemně růžové. Je však účelná k vymezení rozsahu excize, aby byla odstraněna celá transformační zóna.
Nejzávažnější lokalitou v lézi je okolí proximálního okraje, skvamokolumnární junkce, místo vhodné pro biopsii. Méně zkušený vyšetřující se domnívá, že každý okrsek atypie je prekancerózou či známkou invaze.
Kolposkopické „dojmy" ze „stupně zbělání" podle nálady vyšetřujícího nebo z „prominence cévních atypií" jsou nespolehlivé.
Prominující okrsky nemusejí být místem největší závažnosti. Častou chybou je nadhodnocení větší plochy LSIL a opominutí malého okrsku HSIL. Rizikové chyby cílené biopsie, více než 10 %, se vyskytují i při vyšetřování s více než jedním bioptickým odběrem [3, 8, 21, 22, 30].
Kolposkopické nálezy při HSIL
Topografie, kontury povrchu, velikost a distribuce, okraje. Léze HSIL jsou na cervixu lokalizovány centrálně. Obvykle nejsou odděleny od skvamokolumnární junkce, ať jsou na ektocervixu, nebo uvnitř cervikálního kanálu. Jednu z možných výjimek tvoří ženy s reziduální lézí CIN3 po excizním ošetření. Takové přeskočivší „skip" léze nemusejí naléhat na nově tvořenou SCJ a mohou být proximálně uvnitř endocervikálního kanálu. Jsou-li spojeny s méně závažnou neoplazií, jsou léze CIN3 zpravidla blíže SCJ (obr. 168–170).

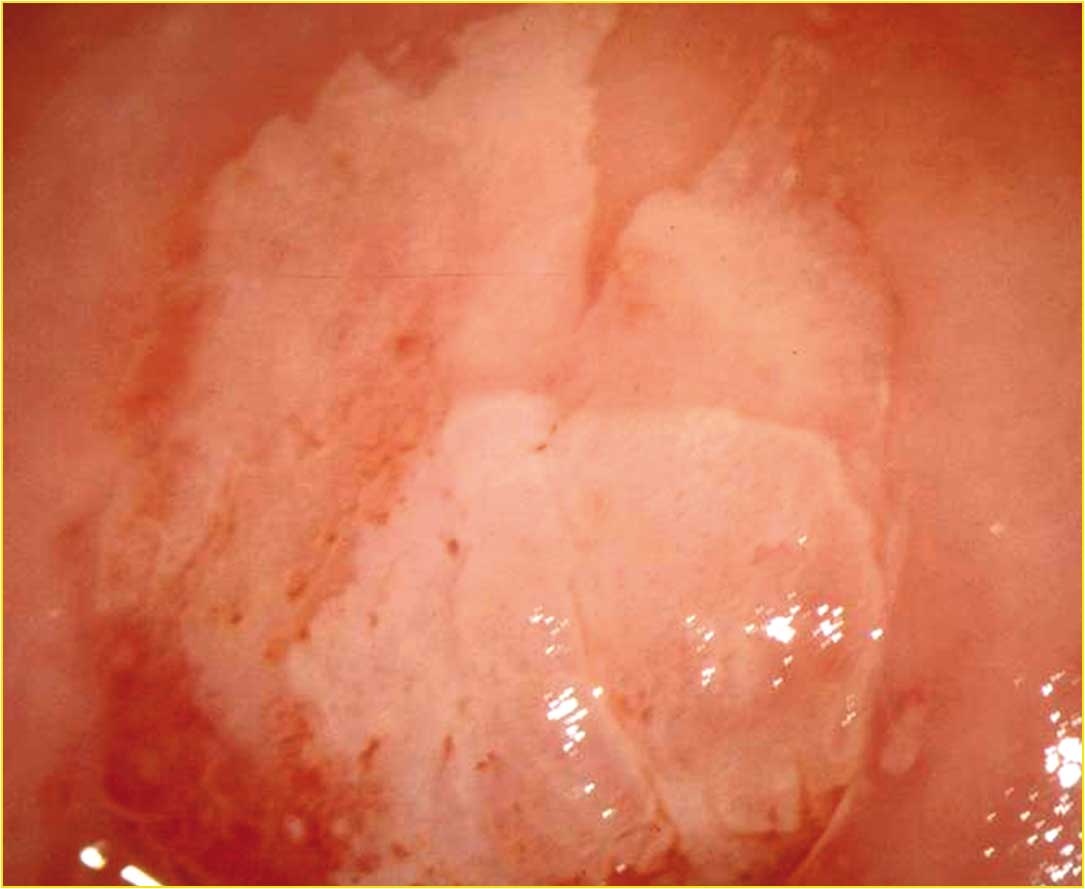
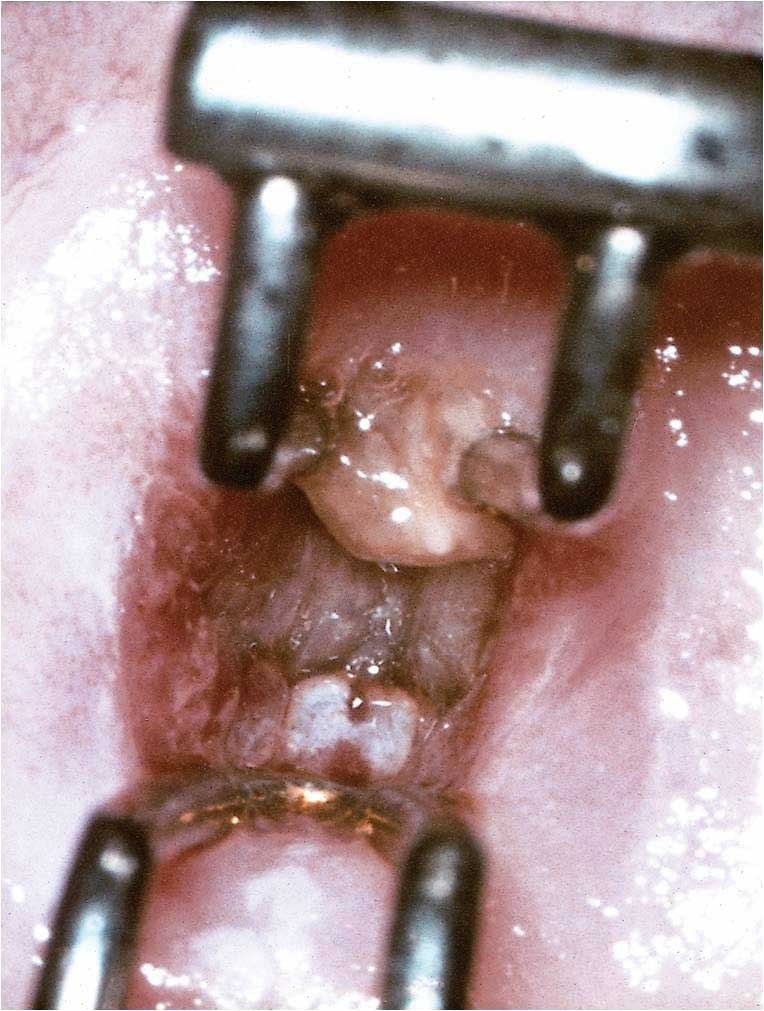
Všeobecně jsou léze CIN2 větší (průměr 5,8 mm) než CIN1 (průměr 4,1 mm), ale menší než CIN3 (průměr 7,6 mm).
Léze CIN3 mají tendenci splývat, jsou delší i širší než CIN1 a CIN2. Nikoli vzácně zaujímá léze CIN3 dva nebo i tři kvadranty cervixu. Protože léze CIN3 splývá a expanduje, mnohdy přesahuje za zevní branku a její horní hranice v hrdle není v kolposkopu patrná.
Okraje CIN2 bývají méně pravidelné a jsou rozeklané nebo zubaté oproti lézím CIN1. Jsou zpravidla hladké, okrouhlé nebo přímé. Vnější okraj připomíná CIN1, když malý ložiskový okrsek CIN2 je lokalizován ve větší oblasti CIN1.
CIN2 může tvořit i periferní lem kolem centrálně umístěné léze CIN3. V takovém případě je okraj přímý s menšími variacemi obr. 171, 172
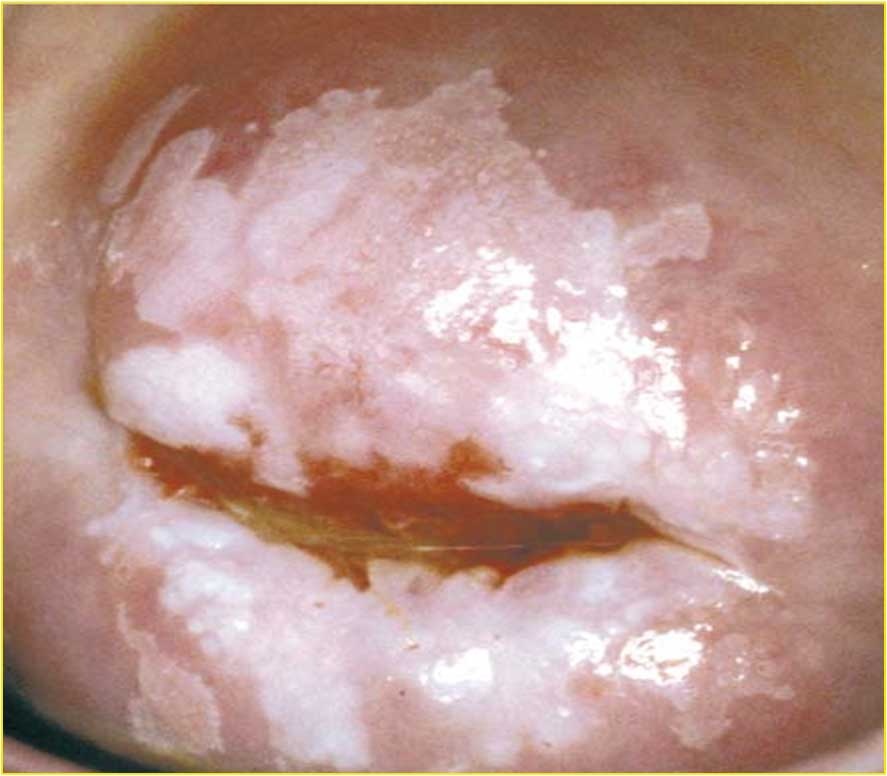
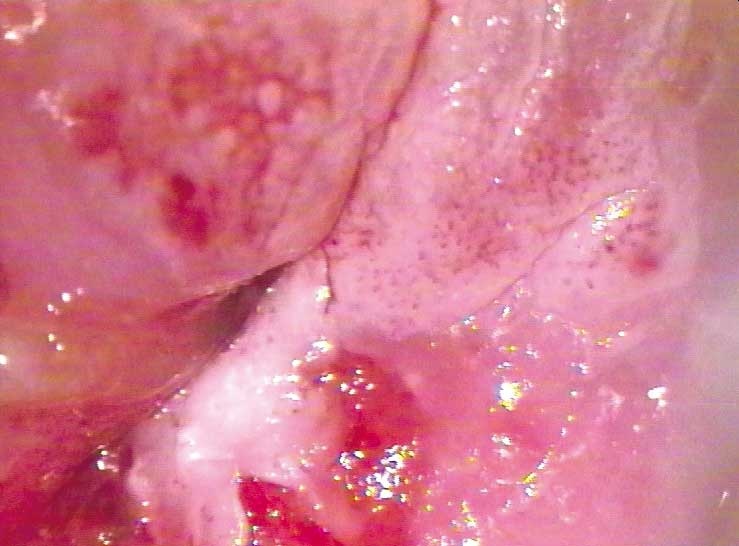
Obr. 171 Je přehledná celá transformační zóna. V horní částri obrazu je nezralá dlaždicobuněčná metaplazie s mozaikou a nezřetelnými okraji. Bio¬psie z dolní části prokázala CIN1. Biopsie ze skvamokolumnární junkce prokázala CIN2
Obr. 172 Atypická transformační zóna zacházejcí do hrdla. Biopsie ze tří míst prokázala : CIN1 (modrá šipka), CIN2 (červená šipka) a CIN3 (černá šipka). Epitel léze CIN3 je ztluštělý. Může se odlučovat od podložního stromatu, protože neoplazie nepříznivě vlisuje hemidesmozomy, které poutají epitel k podložnímu stromatu. V okrscích odloučení lze nalézt malé ulcerace
Okraje lézí CIN3 jsou hladké, mírně zakulacené nebo přímé, se zřetelnou demarkací mezi neoplastickým a normálním epitelem. Narýsování okrajů je nejčastější charakteristikou lézí CIN3. Mohou však mít i odlupující se vnitřní okraje (peeling).
Ztluštělý epitel CIN3 se může odlučovat od podložního stromatu, protože neoplastický proces nepříznivě ovlivní hemidesmozomy, které vážou epitel k bazální membráně a podložnímu stromatu. V okrscích při evulzi epitelu lze nalézt malé ulcerace (obr. 173)
Obr. 173 „Léze v lézi." Nejzávažnější léze je lokalizována centrálně. Léze CIN3 (horní část obrazu – zevní branka), na periferii CIN1. Povšimněte si sytě bílé HSIL v průsvitné okolní běli LSIL
Výraz vnitřní okraj znamená, že ve větší ploše LSIL je centrálně okrsek CIN3 u SCJ. Kolposkopující musí mít na zřeteli, že závažnější léze je lokalizována centrálně. Léze CIN3 obvykle přiléhají k nové SCJ a zacházejí do kanálu hrdla.
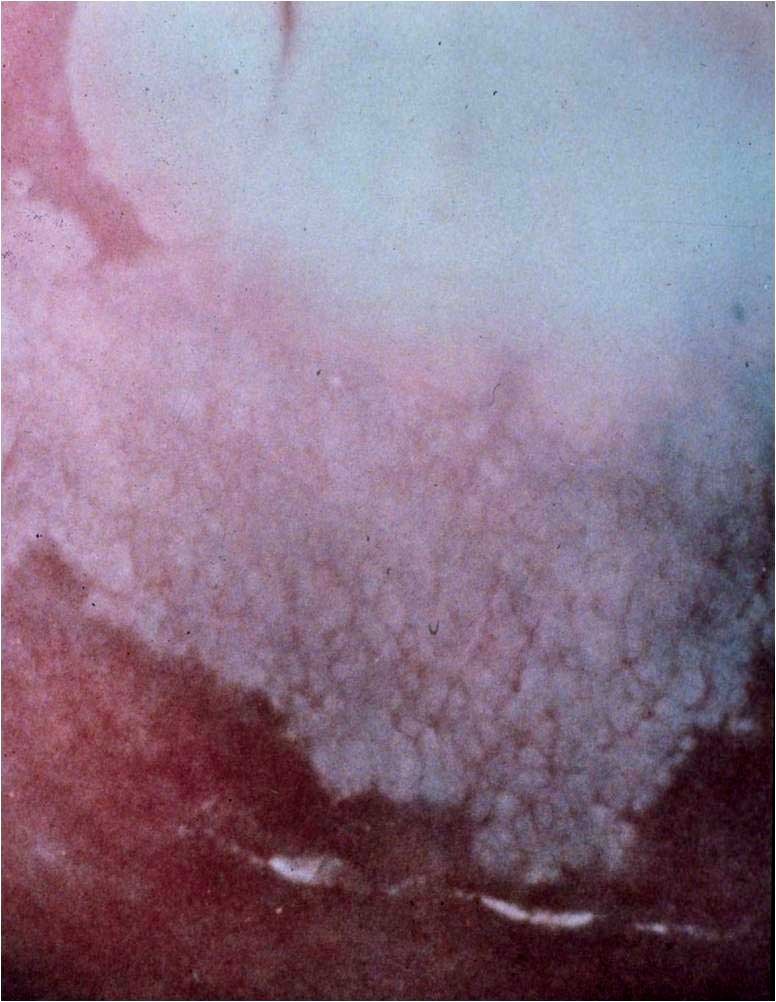
Barva
Léze CIN2 nejsou zářivě bílé nebo sněhobílé. Bílý epitel při CIN2 je obecně méně průhledný než při CIN1 a méně matný než při CIN3. Přesto však se léze CIN2 vyznačují matnou bělí v důsledku větší hustoty buněčných jader v epitelu.
Jejich zbělání také přetrvává déle než krátkodobý efekt při lézích CIN1, opět však platí, že zbělání CIN2 je menšího trvání než při CIN3.
Třebaže matná „perleťová šeď" anebo „sytě bílá" byly výrazy užívané k popisu lézí CIN3, je asi lepší vyjadřovat neprůhlednost (opacitu) epitelu. Léze CIN3 jsou z epitelu s hustým nahloučením jader s množstvím proteinů a malým množstvím vody. Výsledkem je, že epitel účinkuje po aplikaci vodného roztoku kyseliny octové spíše jako zrcadlo, odráží intenzivní bílé světlo kolposkopu. Tato matná bílá barva je pro CIN3 charakteristická (obr. 171, 172).
Léze CIN3 připomínají zeď malovanou opakovaně bílým latexem. Léze CIN1 nebo nezralá metaplazie spíše připomínají základ bílé barvy nebo několik vrstev průsvitné vodové barvy (s výjimkou zářivě bílých kondylomů). Zbělání lézí CIN3 také trvá déle než při CIN1.
Proto, pozorujeme-li rozsáhlou, komplexní lézi cervixu, a byl uniformně aplikován roztok kyseliny octové v téže chvíli, je okrsek s nejdelším přetrváním zbělání patrně okrsek nejzávažnější léze (obr. 176–179). Jestliže CIN3 postihuje epitel obklopující anebo i vyplňující žlázovou kryptu, vidíme pak široké matné pruhy zbělání kolem žlázového ústí.
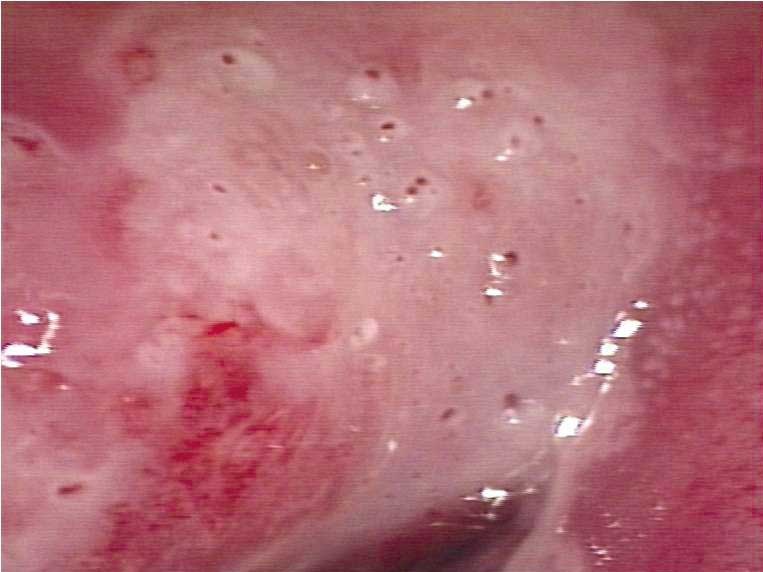 Obr. 176 Matné zbělání léze CIN2
Obr. 176 Matné zbělání léze CIN2
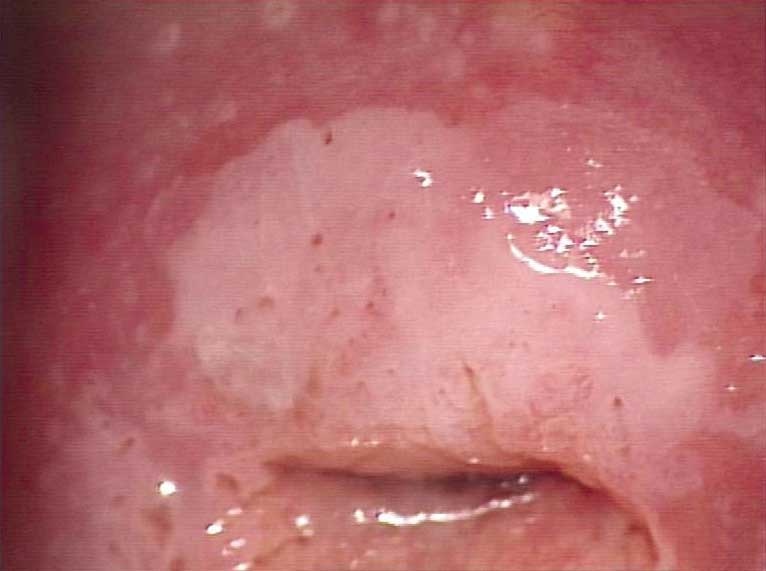
Obr. 177 Léze CIN2 na předním pysku cervixu. Periferně je metaplastický epitel
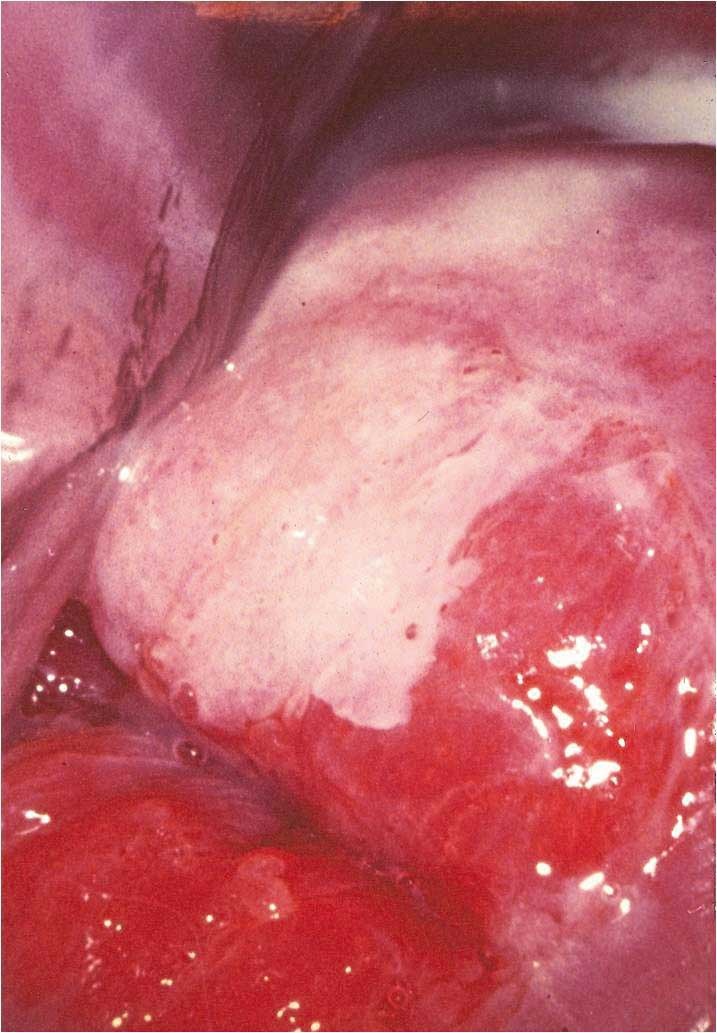 Obr. 178 Matné zbělání (perleťová šeď) léze CIN3
Obr. 178 Matné zbělání (perleťová šeď) léze CIN3
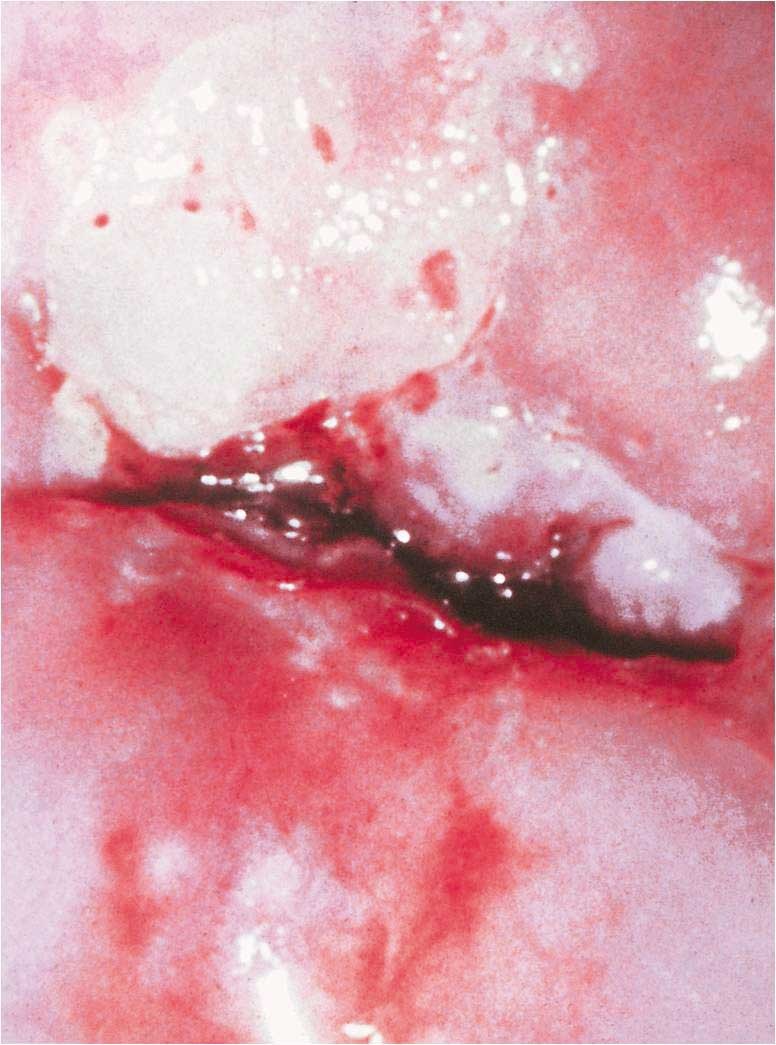 Obr. 179 Sytě bílý epitel léze CIN3 u zevní branky. Léze je dobře ohraničená a její povrch je vyvýšen nad okolní normální tkáň. Epitel vyhlíží jako „sněhově bílý", ale není tomu tak. Problém spočívá v přílišné intenzitě osvětlení kolposkopu
Obr. 179 Sytě bílý epitel léze CIN3 u zevní branky. Léze je dobře ohraničená a její povrch je vyvýšen nad okolní normální tkáň. Epitel vyhlíží jako „sněhově bílý", ale není tomu tak. Problém spočívá v přílišné intenzitě osvětlení kolposkopu
Cévy
V lézích CIN2 je možné nalézat obrazce krevních kapilár jemného až středního kalibru: tečkování i mozaiku. Kapiláry se podobají spíše těm, jež jsou u lézí CIN, nežli kapilárám lézí CIN3. Příležitostně nejsou u lézí CIN2 kapiláry vůbec zřetelné, zejména ihned po aplikaci roztoku kyseliny octové. Vystoupí až při odeznívání efektu kyseliny octové (obr. 181–183).
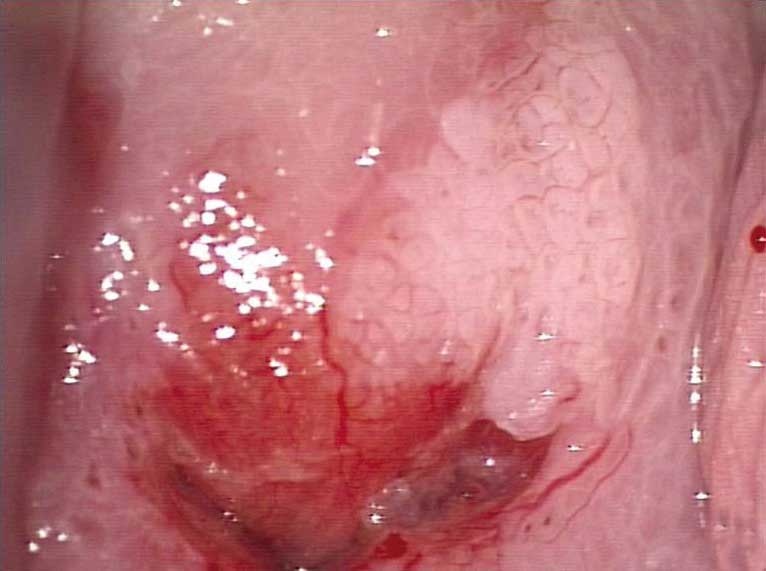 Obr. 181 Jemný nebo jen mírně pozměněný kalibr mozaiky léze CIN2. Matné zbělání epitelu, zřetelné okraje
Obr. 181 Jemný nebo jen mírně pozměněný kalibr mozaiky léze CIN2. Matné zbělání epitelu, zřetelné okraje
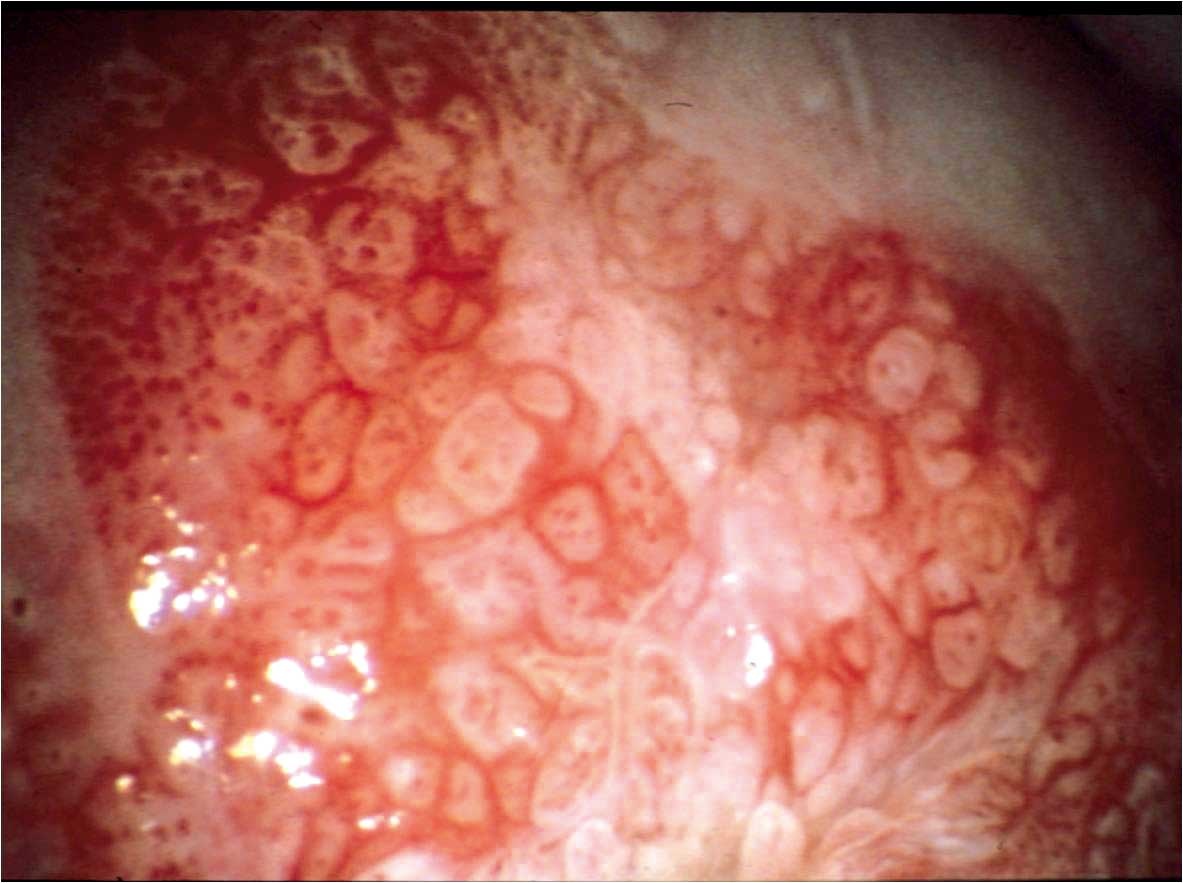 Obr. 182 Hrubé tečkování a hrubá mozaika léze CIN3. Cévy velkého kalibru, asymetrie. Kolposkopicky nelze u léze tohoto typu vyloučit mikroinvazi nebo invazi
Obr. 182 Hrubé tečkování a hrubá mozaika léze CIN3. Cévy velkého kalibru, asymetrie. Kolposkopicky nelze u léze tohoto typu vyloučit mikroinvazi nebo invazi
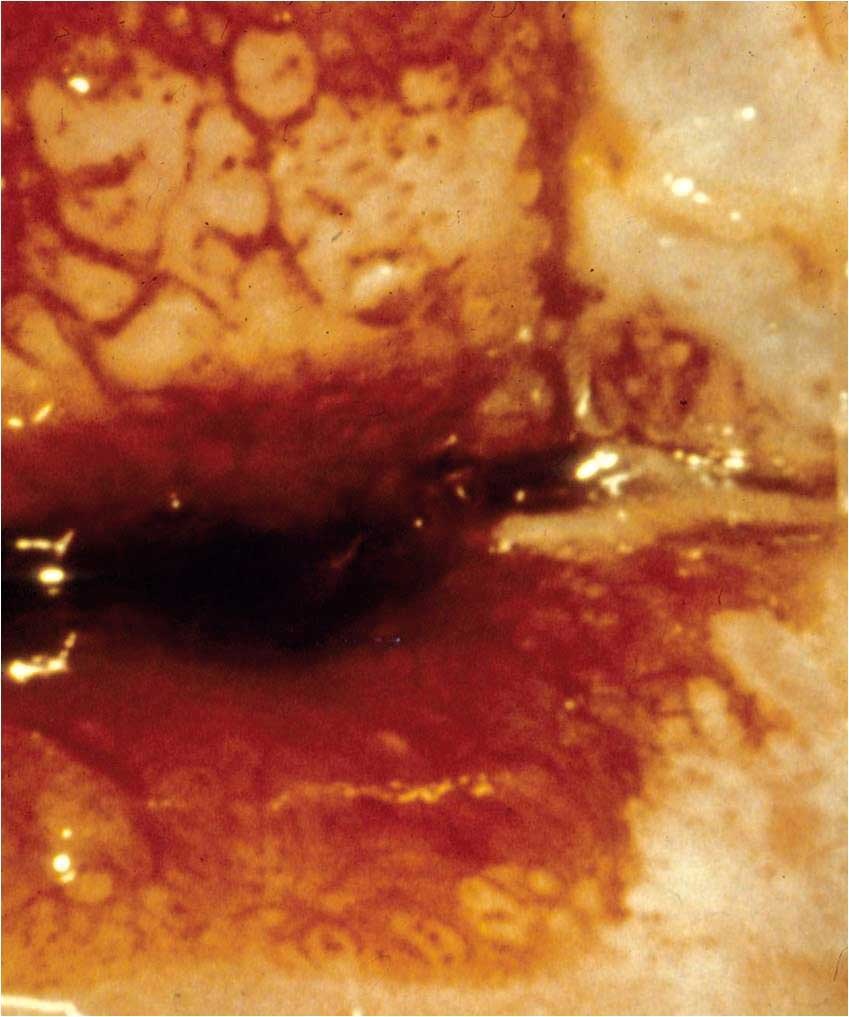 Obr. 183 Hrubé tečkování a hrubá mozaika léze CIN3 na předním pysku u zevní branky. Také v dolní části obrazu jsou cévní vzorce. Od aplikace kyseliny octové v tomto případě uplynul dostatečný interval času a okrsek, v němž zbělání přetrvává, je patrný na č. 12
Obr. 183 Hrubé tečkování a hrubá mozaika léze CIN3 na předním pysku u zevní branky. Také v dolní části obrazu jsou cévní vzorce. Od aplikace kyseliny octové v tomto případě uplynul dostatečný interval času a okrsek, v němž zbělání přetrvává, je patrný na č. 12
Hrubé tečkování a hrubá mozaika jsou jevy charakteristické pro léze CIN3. Pokud je zaznamenáme, nutno předpokládat lézi CIN3.
Dále platí, že interkapilární distance je u lézí CIN3 větší než u lézí CIN1.
Cévní vzorce a interkapilární distance jsou náhodné, nespojité a méně pravidelné než u CIN1. Není však obvyklé vidět kapiláry v tlusté matné lézi CIN3. Patofyziologicky to lze vysvětlit tím, že expandující bloky dysplastického epitelu uzavřely a komprimovaly aferentní i eferentní kličky kapilár normální tkáně.
Tlak potřebný k uzávěru aferentní arterioly je větší než k uzávěru venuly. Proto není krevní kapilární systém CIN3 vidět. U jiných lézí CIN3 vyvíjejí bloky neoplastického epitelu menší tlak, uzavírají jen venuly, čímž vzniká intenzivní dilatace kapilár.
Nebyly prokázány žádné jiné cévní atypie, jež by znamenaly invazi nebo CIN3, třebaže u 2–6 % lézí CIN3 se v histologických preparátech atypie cév nalézají.
Zbarvení jodem
V buňkách lézí CIN2 je buď málo glykogenu, nebo v nich není žádný. Proto žlutá barva jodnegativity je u těchto lézí po aplikaci Lugolova roztoku vždy patrná.
V buňkách lézí CIN3 není žádný glykogen, proto jsou jejich okrsky po aplikaci Lugolova roztoku jodnegativní. Tyto okrsky kopírují dřívější zbělání po aplikaci vodného roztoku kyseliny octové. Jodnegativní jsou jak léze CIN2, tak i léze CIN3, Schillerův test proto nepřispívá k diferenciaci CIN2 od CIN3.
Kolposkopické skórovací systémy stupňování neinvazivních lézí
Systémy stupňování v kolposkopii jsou systematické metody předpovědi závažnosti léze diskriminační analýzou jednotlivých kolposkopických znaků.
Agregace kolposkopických znaků je přesnější pro předpověď klinické závažnosti onemocnění cervixu. Snahy o stupňování založené na míře zbělání nebo na přítomnosti cévních aberací se ukázaly nespolehlivými.
Kolposkopické obrazy na obr. 184–187 znázorňují tři případy s absencí korelace jinak výrazných znamení ve stupňování lézí.
Existují systémy k rozlišení klinicky významných lézí od benigních nonneoplastických změn a ke stupňování závažnosti léze.
Je nutno zdůraznit, že žádný systém stupňování nemohl znát objevitel prvého kolposkopu Hans Hinselmann. Vyvinul nový, poměrně hrubý dvoubodový systém rozdělený do čtyř kategorií „jednoduchého atypického epitelu I a II" a „zvýšeně atypického epitelu III a IV". Jeho pokračovatelé systém rozvinuli a upravili s pokroky poznání abnormalit transformační zóny.
Malcolm Coppleson vyvinul jiný systém v šedesátých letech, založený na barvě a sytosti acetopozitivního zbělání (zbělání I až III).
Adolf Štafl r. 1976 popsal systém stupňování podle čtyř faktorů: vzorce povrchu, barevného tónu, interkapilární distance a okrajů léze vůči normální tkáni.
Jeho systém vyjadřoval nálezy normální, nesignifikantní (zánět), signifikantní (CIN1, 2, 3) a vysoce signifikantní. Důraz položil na interkapilární distanci uvnitř léze a byla vyvinuta metoda měření těchto nepatrných délek. Per Kolstad dokázal, že interkapilární distance koreluje se závažností histopatologických změn.
Louis Burke dále zjemnil přístup ke stupňování lézí. Jeho systém (stupně 1, 2, 3) zvažoval charakteristiky povrchu léze, okrajů, barvy, délku zbělání a charakteristiku léze. Roku 1985 Richard Reid popsal nový a méně subjektivní kolposkopický index k rozlišení LSIL a HSIL.
Reidův index
Reidův index RCI bere v úvahu 4 kolposkopické znaky:
okraje nebo hranice léze
barvu léze po aplikaci vodného roztoku 5% kyseliny octové
charakteristiku krevních kapilár uvnitř léze
odezvu léze na aplikaci Lugolova roztoku jodu
Každé kolposkopické znamení je rozděleno do tří kategorií s číselnou hodnotou 0 až 2. Každý ze čtyř znaků se hodnotí samostatně a výsledné skóre se započítá do indexu.
Celkový součet se užívá k určení kolposkopického vjemu a odhadu závažnosti léze.
Prvé tři znaky se hodnotí po přiměřené aplikaci vodného 5% roztoku kyseliny octové. Čtvrtý znak je možno hodnotit až po aplikaci Lugolova roztoku.
Spolehlivost Reidova kolposkopického indexu
RCI je vyvážený systém, který napomáhá kolposkopujícímu k odhadu závažnosti premaligní léze.
Výsledná hodnota 0–2 svědčí pro nezralou dlaždicobuněčnou metaplazii nebo CIN1.
Hodnota 3–5 náleží CIN2, skóre 6–8 pro léze CIN2/3, přičemž 8 (a více) je varovným znamením suspektního mikroinvazivního nebo invazivního karcinomu.
RCI neskýtá informace stoprocentně odpovídající histologickému nálezu, a to ani při kalkulaci toho nejzkušenějšího kolposkopujícího lékaře. Je však užitečný pro systematický postup v diagnostické rozvaze.
Pro náležitou senzitivitu a specificitu je třeba všechny acetopozitivní léze verifikovat biopsií. (NIH/ASCCP Working Group, 2009). Pro zkušeného kolposkopujícího není samozřejmě nutné v podmínkách ČR striktně toto doporučení dodržovat.
Histopatologie lézí HSIL
Má posoudit tkáňový substrát se zřetelem k okolnostem uváděným na průvodních informacích klinika. Jen precizně formulovaná otázka přináší strukturovanou a validní odpověď.
Malé vzorky, obvykle punch biopsy, vložené do 4% tlumivého formalinu za pokojové teploty:
Makroskopický popis se týká počtu vzorků, jejich průměru v milimetrech, barvy a konzistence, klinik uvádí lokalizaci odběru na cervixu. Sériové řezy parafinových bločků se barví HE, speciálně nebo, pokud je to indikováno, imunohistochemicky.
Mikroskopie vyjádří:
identifikaci tkáně
identifikaci neoplastické léze nebo její absenci
stupeň identifikované léze dlaždicové (CIN1/3, invazivní ca), žlázové léze (CGIN, AIS, invazivní adenokarcinom nebo adenoskvamózní karcinom)
přítomnost změn HPV (koilocytóza, dyskeratóza)
velikost léze
charakteristiku nonneoplastické léze
stromální reakci: přítomnost a rozsah zánětu nebo desmoplastickou reakci, u invazivního karcinomu hloubku invaze, přítomnost lymfovaskulárního postižení a stupeň diferenciace
V Evropě je zatím doporučeno třístupňové určení lézí CIN podle WHO 2003 [9, 15, 17, 18, 19, 27, 28, 43].
Diagnóza CIN3 byla doposud zlatým standardem a má nejlepší úroveň shody mezi různými patology. V malých vzorcích je někdy přípustný závěr „CIN blíže neurčená".
Nález „CIN1/2" by se používat neměl: je tu snadno možná záměna s nezralou dlaždicobuněčnou metaplazií a také s atrofií (Evropská směrnice, 2008). V těchto případech se doporučuje barvení p16 a opakovaná biopsie po přípravě estrogeny [2].
Přesné stupňování lézí CGIN je špatně reprodukovatelné a není prokázáno, že jde o biologické kontinuum (WHO 2003) [9, 43]. Postup při všech stupních verifikovaných CGIN je obdobný, nutno mít na zřeteli početné imitace této morfologie (viz kapitolu o atypických buňkách). Mikroinvazivní adenokarcinom je možné od lézí CGIN odlišit.
Malými vzorky nelze vyloučit invazivní karcinom.
Excizní diagnostická / léčebná operace: výkon chladným nožem, laserovou konizací nebo LEEP (Lletz) má odstranit celou oblast transformační zóny a má obvykle podobu kónusu, válce nebo cylindru, někdy kombinaci obou (tvar mexického sombrera).
Makroskopický popis uvádí rozměry, tvar zevního ústí a lokalizaci cervikálního kanálu, je-li přítomna viditelná léze, a orientaci podle značek (jehla, steh). Cervikální kanál by neměl být poškozen peroperační dilatací.
Jsou různé způsoby sériového prořezání kónusu (Heatley 2001): po otevření, připíchnutí a sérii řezů, nebo fixace celistvého kónusu a následné sériové řezy kolmo na zevní ústí
a) radiálně s identifikací každého řezu
b) rovnoběžné anteroposteriorní řezy zleva doprava s označením alespoň jednoho okraje, části jednoho řezu rozdělené cervikálním kanálem musí být shodné
c) rozpolcení v rovině paralelně s osou cervikálního kanálu, označení okraje, oddělené vložení do fixativu a pak sériové prořezání po 0,1 mm [2, 16]
Kromě precizního popisu histologického typu léze má popis obsahovat i následující informace:
stupeň neoplastické léze
lokalizaci léze v excizní biopsii
uni- či multifokalitu léze
rozsah léze (u mikroinvazivního karcinomu vertikální i horizontální, v milimetrech)
stromální reakci
postižení cév v mikroskopickém měřítku
vztah tumoru k resekčním okrajům
popis a charakteristiku přídatných nonneoplastických lézí (tuboendometroidní metaplazie, mikroglandulární hyperplazie, endometrióza, regenerační a reparační změny) [2, 18, 36, 37, 43]
Pojem mikroinvazivní karcinom dlaždicobuněčný je definován ve stupních IA1 a IA2 (viz kap. XVII).
Adenokarcinom má být popsán týmž způsobem (ale nejsou spolehlivá kritéria pro rozlišení mezi dvěma podjednotkami IA). Nelze-li stanovit míry, má být tumor definován jako malý karcinom IB1.
Přítomnost lymfovaskulární invaze se v nálezu uvádí, ale nemá vliv na určení stadia (dle FIGO) [18].
Kyretáž endocervixu (ECC)
Záměrem je detekce dlaždicových nebo žlázových endocervikálních lézí, jež nemohly být dosaženy kolposkopicky cílenou biopsií.
Přítomnost nebo absence invaze však není z kyretáže průkazná, protože vzorek se týká jen osy endocervikálního kanálu (Cartier).
Kromě toho ECC ruší architekturu lokality a ztíží diferenciální diagnostiku adenokarcinomu in situ a invazivního adenokarcinomu.
Kyretáž razantním výtěrem kartáčkem (brush) má lepší výtěžnost než kyretáž ECC (Andersen aj., 1998, Mogensen aj., 1997). V USA se ECC provádí častěji při nevyhovující kolposkopii, v Evropě je preferována diagnostická konizace (Gath aj., 1995). Kyretáž hrdla není přípustná v graviditě (Wright aj., 2002). Je možné ji provést poté, co byla provedena diagnostická konizace. Zvláštní zřetel si žádá možná kontaminace částic z provedené excize (konizace) v podobě lamel dysplastického epitelu.
Adjuvantním postupem k barvení HE v iniciální diagnostice HSIL z parafinových řezů, pro malé abnormality okrajů resekce, a zejména pro reziduální léze HSIL při negativní/normální cytologii, je v histopatologii a v preparátech tekutého média užití markerů buněčné proliferace a exprese p16INK4a [7, 9, 37].
Senzitivita této kvalitativní detekce dosahuje 99,9 % a může vést k revizi původního morfologického nálezu a jeho nezbytné reinterpretaci [21].
V individuálních rozhodnutích o způsobu ošetření a léčby lézí HSIL je nutno vzít v úvahu, že shoda definitivní, tj. histopatologické diagnostiky, byla mezi experty patologie ve studii ALTS, 2001 pro případy HSIL zjištěna ve 47 % pro LB cytologii, v 77 % pro kolposkopicky zacílené biopsie a v 80 % pro excizní ošetření LEEP, tedy jen v „rozumně mírném" konsenzu.
Zvláštní zřetel si žádají léze v graviditě. Jde o intraepiteliální změnu, po vyloučení invazivního karcinomu je progrese během gravidity vzácná. Proto se léčebný výkon neprovádí, sledování je však nutné formou kolposkopické expertizy. Není žádoucí odběr biopsie z endocervixu. Biopsie z ektocervixu se provádí jen při zhoršení v dalším intervalu průběžného sledování.
Léze HSIL netěhotných žen jsou podle konsenzu expertů České republiky z roku 2008 jednoznačnou indikací pro ošetření excizí s následnou histopatologickou analýzou.
Moderní kolposkopie je více než jen můstek mezi cytologií a histologií. Skýtá další informace o cervikální lézi, jež mají přispět k rozhodování o léčebném postupu („risk stratifier") jak pro pacientku, tak pro lékaře (proto je vhodná demonstrace videořetězcem) a je i nástrojem supervize a auditu kolposkopické praxe [8, 22, 25, 27].
Problematiku metody „see and treat" řeší současný konsenzus expertů v ČR rezervovaným přístupem, aby se zabránilo nadměrným výkonům. Výkon je odborně přijatelný jen pro certifikovaného experta kolposkopie.
Literatura
- Apgar BS, Brotzman GL, Spitzer M. Colposcopy. Principles and Practice. An Integrated Textbook and Atlas. Philadelphia: W.B. Saunders Co.; 2002.
- Arbyn M, Anttila A, Jordan J, et al. European Guidelines for Quality Assurance in Cervical Cancer Screening. 2nd ed. Luxembourg: IARC, European Communities; 2008.
- Austin RM. The detection of precancerous cervical lesions can be significantly increased: Who cares and who should know? College of American Pathologists. 2003;127(2):143–5.
- Benedet JL, Pecorelli S. Staging classifications and clinical practice guidelines of gynaecologic cancer. Int J Obstet Gynecol. 2000;70:207–312.
- Bowring J, Strander B, Young M, et al. The Swede Score: Evaluation of scoring system designed to improve the predictive value of colposcopy. J Low Genit Tract Dis. 2010;14:301–5.
- Burghardt E, Pickel H, Girardi F. Colposcopy – Cervical Pathology. Textbook and Atlas. 3rd ed. New York: Thieme; 1998. p. 203–16.
- Carydis VB, Walker T, Wing A, Colgan TJ. Utility of p16ink4a immunocytochemistry in liquid-based cytology specimens from women treated for high-grade squamous intraepithelial lesions. Acta Cytol. 2007;51:517–22.
- Cox JT. More questions about the accuracy of colposcopy: what does this mean for cervical cancer prevention? Obstet Gynecol. 2008;111:1266Y 7.
- Dallenbach-Hellweg G, Doeberitz MK, Trunk MJ. Color Atlas of Histopathology of the Cervix Uteri. 2nd ed. Berlin: Springer; 2006.
- Davey DD, Austin RM, Birdsong G, Buck HW, Cox JT, Darragh TM, et al. ACCP Patient Management Guidelines: Pap Test Specimen Adequacy and Quality Indicators. J Low Genit Tract Dis. 2002;6(3):195–9.
- Driák D, Dyrhonová M, Tachezy R. Vakcinace proti lidským papilomavirům a její kontroverze - I. Gynekolog. 2009;3:128–33.
- El-Sayed MM, Al-Daraji WI, Finnegan CM, et al. Cost-effectiveness of Active Versus Conservative Colposcopic Management of Mild Dyskaryosis. Int J Clin Exp Pathol. 2009, 2, s. 261 – 266.
- European Guidelines For Quality Assurance in Cervical Cancer Screening. 2nd ed. Luxembourg: IARC, European Communities; 2008.
- Ferris DG, Cox JT, O'Connor DH et al. Modern Colposcopy. 2nd ed. Iowa: Kendall/Hunt Publishing Company; 2004. Chapter 9: Colposcopy of Cervical Intraepithelial Neoplasia. p. 250–317.
- Fu YS. Pathology of the Uterine Cervix, Vagina, and Vulva (Major Problems in Pathology, Vol 21). Philadelphia: Elsevier Science; 2002.
- Heatley MK. How many histological levels should be examined from tissue blocks originated in cone biopsy and large loop excision of the transformation zone specimens of cervix? J ClinPathol. 2001;54:650–1.
- Heatley MK. How should we grade CIN? Histopathology. 2002;40:S377–80.
- Horvat R, Herbert A, Jordan J, Bulten J, Wiener HG. Techniques and Quality Assurance Guidelines for Histopathology. In: European Guidelines for Quality Assurance in Cervical Cancer Screening, 2nd ed. Luxembourg: IARC, European Communities; 2008. p. 175–89.
- Ismail SM. Fiander AN. Grading cervical intraepithelial neoplasia. Histopathology. 2002;40:S385–90.
- Jenkins D. In: Singer A, editor. Premalignant Lesions of the Lower Genital Tract. Vol.2. Elsevier; 1990. p. 51–85.
- Jordan JA, Singer A, Jones H, Shafi MI, editors. The Cervix. 2nd ed. Oxford: Blackwell Publishing; 2006.
- Massad LS, Jeronimo J, Katki HA, Schiffman M; NIH/ASCCP Research Group. The accuracy of colposcopic grading for detection of high-grade cervical intraepithelial neoplasia. J Low Genit Tract Dis. 2009;13:137–44.
- Massad SL, Markwell S, Cejtin HE, Collins Y. Risk of high-grade cervical intraepithelial neoplasia among young women with abnormal screening cytology. J Low Genit Tract Dis. 2005;9(4):225–9.
- Mortakis A. Intraepithelial Neoplasia of the Cervix. An Integrated Textbook and Colposcopy Atlas. Athens: Litsas Medical Publications; 1991.
- Mossa MA, Carter PG, Barton DP, Young MP. Cervical intraepithelial neoplasia in postmenopausal women: difficulties in cytology, colposcopy and treatment. The Obstetrician & Gynaecologist. 2001;3(1):8–12.
- Nygard JF, Sauer T, Skjeldestad FE, et al. CIN 2/3 and cervical cancer after an ASCUS pap smear: a 7-year, prospective study of the Norwegian population-based, coordinated screening program. Acta Cytol. 2003;47:991–1000.
- O'Connor DM. A tissue basis for colposcopic findings. Obstet Gynecol Clin N Am. 2008;35:565–82.
- Padilla-Paz LA, Carlson J, Twiggs LB, et al. Evidence supporting the current management guidelines for high-grade squamous intraepithelial lesion cytology. J Low Genit Tract Dis. 2004;8(2):139–46.
- Pathology and Genetics of Tumours in the Breast and Female Genital Organs World Health Organization Classification of Tumours. Lyon: IARC Press; 2003.
- Pretorius RG, Zhang WH, Belinson JL, Huang MN, Wu LY, Zhang X, et al. Colposcopically directed biopsy, random biopsy, and endocervical curettage in the diagnosis of cervical intraepithelial neoplasia II and worse. Am J Obstet Gynecol. 2004;191:430Y4.
- Reid R, Scaizi P. Genital warts N.D. cervical cancer. VI. An improved colposcopic index for differentiating benign papillomaviral infections from high-grade cervical intraepithelial neoplasia. Am J Obstet Gynecol. 1985;153:611.
- Robová H. Kolposkopie v graviditě, Čes Gynek.
- Sellors JW, Sankaranarayanan R. Colposcopy and Treatment of Cervical Intraepithelial Neoplasia. A Beginner's Manual. Lyon: CEDEX; 2003/4. Dostupný na: http://screening.iarc.fr/colpoforeword.php.
- Sherman AI. Comparison of cancer cell surfaces of the lower reproductive tract by scanning electron microscopy. Am J Obstet Gynecol. 1977;129:893–908.
- Singer A, Monaghan JM, Quek SCh, Deery ARS. Lower Genital Tract Precancer: Colposcopy, Pathology and Treatment. Oxford: Blackwell Science; 2000.
- Stoler MH, Schiffman M. Interobserver reproducibility of cervical cytologic and histologic interpretations. Realistic estimates from the ASCUS-LSIL triage study. JAMA. 2001;285:1500–5.
- Syrjänen K. Histology of CIN and cervical cancer. EUROGIN 2008: Joining Forces for Cervical Cancer Prevention.
- Ueda M, Ueki, M. Immunohistochemical study on the expression of epidermal growth factor receptor and c-myc oncogene product in precancerous lesions of the uterine cervix. The Cervix and Lower Female Genital Tract. 1993;11:93–6.
- Vernerová Z. Problematika cervikálních lézí z pohledu patologa. Prakt Gyn. 2004;4:40–2.
- Voojis GP, Benign Proliferative Reactions, Intraepithelial Neoplasia and Invasive Cancer of the Uterine Cervix. In: Bibbo M, editor. Comprehensive Cytology. Philadelphia: W.B. Saunders Co.; 1991. p.153–230.
- Weaver EJ, Kovatich AJ, Bibbo M. Cyclin E expression and early cervical neoplasia in ThinPrep specimens: a feasibility study. Acta Cytol. 2000;44:301–4.
- Walker P,Dexeus S, DePalo G, et al. International terminology of colposcopy: an updated report from the International Federation for Cervical Pathology and Colposcopy. Obstet Gynecol. 2003;101/1:175–7.
- Wilson GE. The classification of cervical intraepithelial neoplasia. Histopathology. 2002;40:S380–5.
